
 a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题:
a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题:分析 a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l,若n=3,则a为Cl,b、c、d不能都处于短周期,不符合题意,则n=2,a为N元素;b、d同主族,能形成两种中学常见的化合物,则b为O元素、d为S元素;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质,则c为Al;e原子有四个能层,其未成对电子数在同周期是最多的,外围电子排布为3d54s1,则e为Cr.
解答 解:a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l,若n=3,则a为Cl,b、c、d不能都处于短周期,不符合题意,则n=2,a为N元素;b、d同主族,能形成两种中学常见的化合物,则b为O元素、d为S元素;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质,则c为Al;e原子有四个能层,其未成对电子数在同周期是最多的,外围电子排布为3d54s1,则e为Cr.
(l)a为N元素,在周期表中的位置:第二周期VA族;e原子有四个能层,其未成对电子数在同周期是最多的,价电子电子排布式为3d54s1,3d轨道中的5个电子为单电子,
故答案为:第二周期VA族;3d54s1;5;
(2)同周期随原子序数增大,电负性增大趋势,同主族自上而下电负性减小,故电负性:O>S>Al,
因为N元素的3p轨道为半满状态,比较稳定,故N元素第一电离能高于氧元素的,
故答案为:O>S>Al;因为N元素的3p轨道为半满状态,比较稳定;
(3)a和b形成的离子W呈平面正三角形,中心原子杂化轨道数目为3,其中心原子的杂化类型为 sp2杂化,由于非金属性O>N、O>S,故氢化物中H2O最稳定,
故答案为:sp2杂化;H2O;
(4)a和b形成的离子W呈平面正三角形,则W为NO3-,b、d组成的极性分子为SO2,SO2通入含少量NO3-离子的BaCl2水溶液中,有NO气体生成.发生反应的离子方程式为:3SO2+2NO3-+3Ba2-+2H2O=3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+2NO3-+3Ba2-+2H2O=3BaSO4↓+2NO↑+4H+;
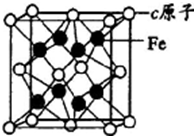
(5)元素Al与Fe构成合金属于金属晶体,晶胞中Al原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞中Fe原子数目为8,则该合金的化学式为AlFe2,离铁原子最近的Al原子构成的图形为正四面体,
铁原子之间的最短距离为晶胞棱长的$\frac{1}{4}$,晶胞质量为4×$\frac{27+112}{{N}_{A}}$g,若该晶胞的密度为ρg/cm3,则晶胞棱长为$\root{3}{\frac{4×\frac{27+112}{{N}_{A}}}{ρ}}$cm,故铁原子之间最近距离为$\frac{1}{4}$×$\root{3}{\frac{4×\frac{27+112}{{N}_{A}}}{ρ}}$cm,
故答案为:金属晶体;AlFe2;正四面体;$\frac{1}{4}$×$\root{3}{\frac{4×\frac{27+112}{{N}_{A}}}{ρ}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电负性、电离能、杂化方式与空间构型、晶胞计算、氧化还原反应等,熟练掌握元素化合物性质,掌握杂化方式与微粒空间构型关系,(5)中注意利用过原子的平面平分立方体判断距离.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
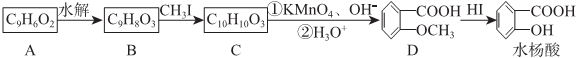
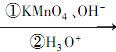 RCOOH+R1COOH
RCOOH+R1COOH .
.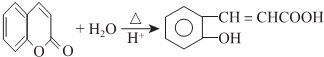 .
.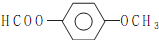 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
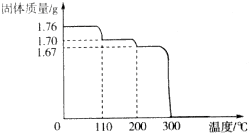

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨生产中将NH3液化分离,虽可提高N2、H2的转化率但减小了反应速率 | |
| B. | 硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 | |
| C. | 电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室 | |
| D. | 侯氏制碱法是将氨气和二氧化碳先后通入饱和氯化钠溶液中,制得碳酸氢钠固体,再在高温下灼烧,转化为碳酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH2CH2OH | B. | CH3OH | C. | CH3CH2OH | D. | HOCH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该锂电池在放电过程中,Li+从正极区向负极区迁移 | |
| B. | 电解质溶液中混入水,对电池反应无影响 | |
| C. | 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3 | |
| D. | 电池工作过程中,金属锂提供的电子与正极生成硫的物质的量之比为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验方案 | A | B | C | D |
| 图 | 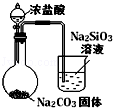 | 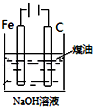 | 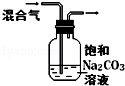 | 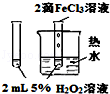 |
| 实验目的 | 比较HCl、H2CO3和H2SiO3的酸性强弱 | 制备Fe(OH)2并能较长时间观察其颜色 | 除去CO2气体中混有的SO2 | 验证FeCl3对H2O2分解反应有催化作用 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com