
| A、483.6 kJ |
| B、88 kJ |
| C、285.8 kJ |
| D、44 kJ |
科目:高中化学 来源: 题型:
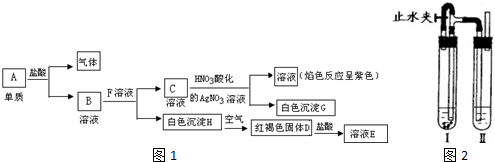
查看答案和解析>>
科目:高中化学 来源: 题型:
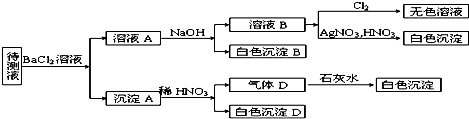
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49% |
| B、配制0.1mol/L的Na2CO3溶液480mL,需要500mL容量瓶 |
| C、在标准状况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水 |
| D、在2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O中,氯气是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入足量CO2后的溶液中:Na+、SiO32-、C6H5O-、CH3COO- | ||
B、
| ||
| C、pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- | ||
| D、c(ClO-)=1.0 mol?L-1的溶液:Na+、SO32-、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
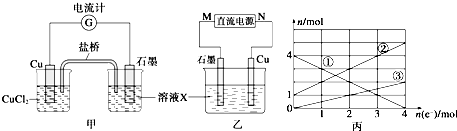
查看答案和解析>>
科目:高中化学 来源: 题型:
| 13 |
| 2 |
| 13 |
| 2 |
| 9 |
| 2 |
| 9 |
| 2 |
| A、2 878 kJ/mol |
| B、2 658 kJ/mol |
| C、1 746 kJ/mol |
| D、1 526 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、② | B、③ | C、①和④ | D、②和③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNaOH的质量为40g?mol-1 |
| B、标准状况下,1molH2O2的体积为22.4L |
| C、3.01×1023个SO2分子的质量为32g |
| D、CH4的摩尔质量为16g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com