
【题目】葡萄酒等果酒易发生变质,常加入抗氧化剂。如图是一种抗氧化剂的制取装置。实验前已除尽装置内的空气,实验后装置Ⅱ中有Na2S2O5晶体析出。
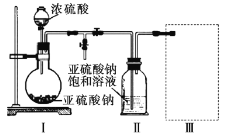
(1)实验前除尽装置内空气的原因是___。
(2)装置Ⅰ中的玻璃仪器的名称___。
(3)要从装置Ⅱ中获得纯净的晶体,操作方法是___。
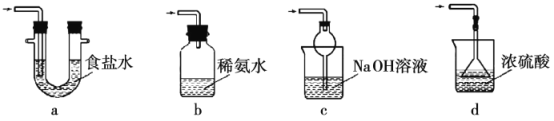
(4)下列可用于装置Ⅲ的为___(填序号)。
(5)设计实验证明Na2S2O5晶体在空气中可能被氧化,实验方案是___。
【答案】防止抗氧化剂被氧化 圆底烧瓶、分液漏斗 过滤、洗涤、干燥 c 取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸、振荡,再滴入氯化钡溶液,有白色沉淀生成
【解析】
(1)抗氧化剂具有较强还原性,则实验前除尽装置内空气的目的就是除去氧气,防止抗氧化剂被氧化;
(2)装置Ⅰ中的玻璃仪器包括圆底烧瓶和分液漏斗;
(3)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤、洗涤、干燥等操作;
(4)a.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故a错误;
b.装置应将导管伸入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故b错误;
c.该装置中氢氧化钠与二氧化硫反应,可以吸收二氧化硫,且防止倒吸,故c正确;
d.该装置不能吸收二氧化硫,所以无法实现实验目的,故d错误;
故答案为:c;
(5)Na2S2O5中S元素的化合价为+4价,因此会被氧化为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】根据下列有机分子的模型回答问题
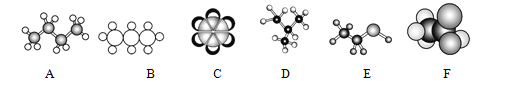
(1)写出A、B、C、D的结构简式:
A:_____ B、_____ C、__________ D、________
(2)E、F中官能团的名称分别是:_________ _________
(3)用“同分异构体”“同系物”填空:
A与B的关系是互为:__________ A与D的关系是互为:_________
(4)A的一氯代物有_____种,B的二氯代物有_____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族。m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在XZ2中,n是一种二元弱酸。上述物质的转化关系如图所示(反应条件省略)。下列说法正确的是
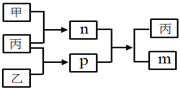
A. 原子半径:W<X<Y B. 非金属性:Y>Z>X
C. Y与Z组成的化合物一定有漂白性 D. W与X组成的化合物中只有极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,工业上由铬铁矿(主要成分为FeOCr2O3、SiO2等)制备,制备流程如图所示:

已知:a.步骤①的主要反应为:2FeOCr2O3+4Na2CO3+ 7NaNO3 ![]() 4Na2CrO4+Fe2O3+4CO2+7NaNO2
4Na2CrO4+Fe2O3+4CO2+7NaNO2
b.Cr2O42-+2H+ ![]() Cr2O72-+H2O,下列说法不正确的是
Cr2O72-+H2O,下列说法不正确的是
A. 步骤①反应中Na2CrO4和Fe2O3为氧化产物
B. 步骤①熔融、氧化可以在石英坩埚中进行
C. 滤渣2中含有H2SiO3
D. 步骤④调滤液2的pH使之变小有利于Cr2O72-生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸锌作为补锌药,具有见效快、吸收率高、副作用小、使用方便等优点。某学习小组在实验室以葡萄糖和氧化锌为主要原料合成该物质。
反应原理:CH2OH(CHOH)4CHO + H2O2 ![]() CH2OH(CHOH)4COOH + H2O
CH2OH(CHOH)4COOH + H2O
2CH2OH(CHOH)4COOH + ZnO ![]() Zn[CH2OH(CHOH)4COO] 2 + H2O
Zn[CH2OH(CHOH)4COO] 2 + H2O
设计的合成路线为:
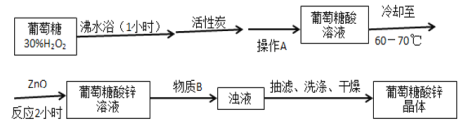
相关信息如下:
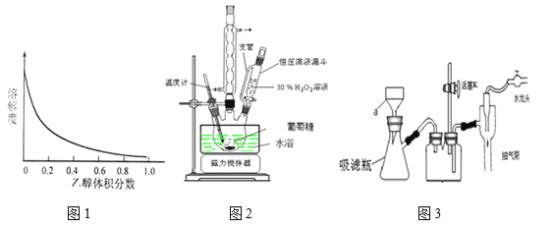
葡萄糖酸锌易溶于水,在乙醇与水的混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图1
实验中所涉及的部分装置如图所示(图2装置先制备葡萄糖酸,再与ZnO反应制备
葡萄糖酸锌),图3为抽滤装置
请根据以上信息,回答下列问题:
(1)图2中恒压滴液漏斗的支管的作用是___________,图3中a装置的名称____________。
(2)30%H2O2所用的物质的量大概是葡萄糖的3倍,而且并未一次性与葡萄糖混合,而是利用恒压滴液漏斗缓慢滴加的理由_________________________________。
(3)操作A是______________,物质B是________________。
(4)抽滤完毕或中途停止抽滤时,应先___________________,然后____________________。
(5)三颈烧瓶中的葡萄糖酸锌晶体转入到抽滤装置中时,瓶壁上往往还粘有少量晶体,需选用液体将瓶壁上的晶体冲洗下来后转入到抽滤装置中,下列液体最合适的是_______。
A 无水乙醇 B 饱和NaCl溶液 C 70%乙醇水溶液 D 滤液
(6)下列说法正确的是________。
A 用银氨溶液来替代30%H2O2将葡萄糖转变成葡萄糖酸,既经济又方便
B ZnO粉末与葡萄糖酸反应时,利用磁力搅拌可以增大ZnO粉末与葡萄糖酸的接触面积,加快反应速率
C 在抽滤过程中,如果吸滤瓶中的液体快接近支管口时,则拔掉吸滤瓶上的橡皮管,并从吸滤瓶的支管口倒出溶液
D 将葡萄糖酸锌晶体放在干燥器中可以防潮,在干燥器中放有干燥剂,并添加了无水CoCl2来指示是否得更换干燥剂,如果CoCl2为蓝色,说明干燥剂已经失效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是某药物中间体L的合成路线:
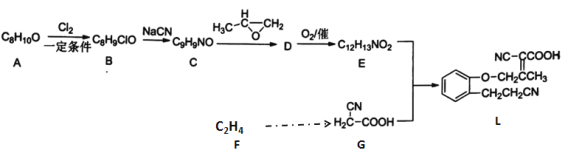
已知:
RCH2COOH![]()
请回答:
(1)有机物A的结构简式________。
(2) 下列说法不正确的是________。
A 有机物A转化成B的条件是铁粉作为催化剂
B 有机物C转化成D原子利用率可达100%
C 用铜丝蘸取有机物B放在酒精灯上灼烧,火焰显绿色
D 有机物D不能使酸性高锰酸钾溶液褪色
(3) E+G→L的化学方程式是________________。
(4) 写出符合下列条件的A的所有同分异构体__________________。
①含有苯环②核磁共振氢谱显示有4种氢原子
(5)设计以F 为原料合成G流程____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂电池由于能量密度大逐渐取代锌电池。常用锂电池的正极材料为磷酸亚铁锂(LiFe-PO4),可采用FeCl3、NH4H2PO4、LiCl和苯胺等原料制备。回答下列问题:
(1)Fe基态原子核外电子排布式为___。
(2)已知Li2O是离子晶体,其晶格能的Born-Haber循环如图所示。
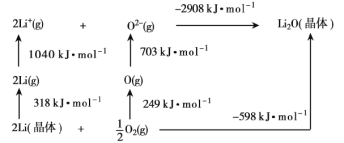
如图可知,Li原子的第一电离能为___kJ·mol-1,O=O键键能为___kJ·mol-1,Li2O晶格能为__kJ·moL-1。
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为___,其中Fe的配位数为___。
(4)NH4H2PO4中,P的杂化轨道类型为___。
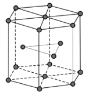
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为___。六棱柱底边边长为a cm,高为ccm,阿伏加德罗常数的值为NA,Zn的密度为___g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用固体表面催化工艺进行NO分解的过程如下图所示。
![]()
下列说法不正确的是
A.NO属于共价化合物
B.O2含有非极性共价键
C.过程②吸收能量,过程③释放能量
D.标准状况下,NO分解生成11.2LN2转移电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代社会发展的支柱之一。
(1)化学反应中的能量变化,主要表现为热量的变化。
①下列反应中,属于放热反应的是_________(填字母)。
a.Ba(OH)2·8H2O与NH4Cl混合搅拌
b.高温煅烧石灰石
c.铝与盐酸反应
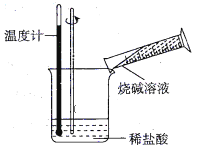
②某同学进行如图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明,反应温度升高;由此判断该反应是_____________(填“吸热”或“放热”)反应,其离子方程式是__________________________。
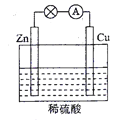
(2)电能是现代社会应用最广泛的能源之一。如图所示的原电池装置中,负极是____,正极上能够观察到的现象是________,正极的电极反应式是____________。原电池工作一段时间后,若消耗锌6.5 g,则放出气体_______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com