
| t/s | 0 | 500 | 1000 | 1500 |
| n(X)/mol | 4.00 | 2.80 | 2.00 | 2.00 |
| A. | 平衡不移动 | |
| B. | 重新达到平衡后,再充入的M转化率小于50% | |
| C. | 重新达到平衡后,Y的平均反应速率与原平衡相等 | |
| D. | 重新达到平衡后,用X表示的v(正)比原平衡大 | |
| E. | 重新达到平衡后,混合气体中Y的体积分数增大 | |
| F. | 重新达到平衡后,M的物质的量浓度是原平衡的1.5倍 |
分析 根据反应2X(g)+Y(g)?3M(g)+N(s)可知,该反应是气体体积不变的反应,若再加入3.00molM,3.00molN,折算成X、Y相当于再加入2molX和1molY,由于N是固体,N的加入对平衡没有影响,所以再加入3.00molM,3.00molN后,反应达到平衡时与原平衡为等效平衡,由于是体积为2L的恒容密闭容器,所以达到新平衡时,气体浓度为原平衡的1.5倍,据此答题;
解答 解:根据反应2X(g)+Y(g)?3M(g)+N(s)可知,该反应是气体体积不变的反应,若再加入3.00molM,3.00molN,折算成X、Y相当于再加入2molX和1molY,由于N是固体,N的加入对平衡没有影响,所以再加入3.00molM,3.00molN后,反应达到平衡时与原平衡为等效平衡,由于是体积为2L的恒容密闭容器,所以达到新平衡时,气体浓度为原平衡的1.5倍,
A、根据上面的分析可知,两个平衡为等效平衡,故A正确;
B、由于两个平衡为等效平衡,M转化率不变,故B错误;
C、由于压强增大,所以反应速率都增大,故C错误;
D、由于压强增大,用X表示的v(正)比原平衡大,故D正确;
E、由于两个平衡为等效平衡,混合气体中Y的体积分数不变,故E错误;
F、根据上面的分析可知,重新达到平衡后,M的物质的量浓度是原平衡的1.5倍,故F正确,
故选ADF.
点评 本题主要考查化学平衡的移动及等效平衡、反应热及化学反应速率的计算等,等效平衡的分析是解答中的难点,中等难度.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
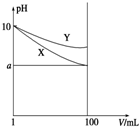 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释到100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释到100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | 稀释后X溶液中水的电离程度比Y溶液中水电离程度小 | |
| B. | 若X、Y是一元碱,等物质的量浓度的盐酸盐溶液Y的pH大 | |
| C. | 若8<a<10,则X、Y都是弱碱 | |
| D. | 完全中和X,Y两溶液时,消耗同浓度稀硫酸的体积V(X)>V(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时 体系能量的变化 | ||
| A | B | C | ||
| ① | 1 | 2 | 0 | 吸收热量:0.25akJ |
| ② | 0.5 | 1 | 1 | 吸收热量:Q kJ |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 平衡时,两个容器中C的体积分数均约为18% | |
| C. | 容器②中达到平衡时吸收的热量Q=0.25a kJ | |
| D. | 若其他条件不变,把容器①的体积改为2L,则平衡时吸收的热量小于0.25a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶于水得到相对应的碱 | B. | 它对应的水合物是可溶于性强碱 | ||
| C. | 它与强酸溶液反应只生成盐和水 | D. | 它是金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3+HCl═NH4Cl | B. | H2S+Na2S═2NaHS | ||
| C. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 | D. | CO2+NaOH═NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A与B形成的化合物为酸性氧化物 | |
| B. | 简单离子半径:D>B>C | |
| C. | 由这四种元素中的任意三种组成的无机盐溶于水均可促进水的电离 | |
| D. | 相同质量的C、D单质分别与足量的稀盐酸反应.前者生成的氢气更多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com