
| A. | ④⑤③ | B. | ⑥①⑤③ | C. | ③⑤①② | D. | ⑥① |
分析 乙醇不与氢氧化钠溶液反应,苯酚和氢氧化钠溶液反应,全部变成苯酚钠.这样原来的溶液就变成了苯酚钠、氢氧化钠溶液(加入氢氧化钠溶液是过量的)中混有乙醇.根据乙醇和水的沸点不同,加热蒸馏乙醇被全部蒸馏掉,而剩下的苯酚钠、苛性钠溶液不变.最后通入过量的二氧化碳气体,氢氧化钠全部转化为苯酚.苯酚不溶水,与生成的NaHCO3溶液分层,静置后分液可以得到苯酚.
解答 解:根据乙醇不与氢氧化钠溶液反应,加入氢氧化钠溶液后,苯酚的乙醇溶液中,乙醇不会发生任何变化,但苯酚全部变成苯酚钠.这样原来的溶液就变成了苯酚钠、氢氧化钠溶液(加入氢氧化钠溶液是过量的)中混有乙醇.乙醇的沸点是78度,水的沸点是100度.这样加热到78度,达到乙醇的沸点,乙醇被全部蒸馏掉,而剩下的苯酚钠、氢氧化钠溶液不变.最后通入过量的二氧化碳气体,由于碳酸酸性强于苯酚酸性,所以加入二氧化碳后,氢氧化钠先全部转化为NaHCO3(加入过量二氧化碳),然后苯酚钠全部转化为苯酚.苯酚不溶水,与生成的NaHCO3溶液分层,静置后分液可以得到苯酚,
即正确的操作为⑥加入足量NaOH溶液、①蒸馏、⑤通入足量CO2、③静置分液,
故选B.
点评 本题考查混合物的分离,注意苯酚和乙醇的性质差异是解答的关键,题目难度不大,熟悉蒸馏、分液即可解答.


科目:高中化学 来源: 题型:解答题
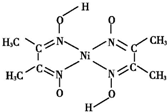 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.
金属镍及其化合物在合金材料以及催化剂等方面应用广泛. 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
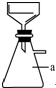 实验室用粗锌(含铅等杂质)与过量的稀硫酸反应制氢气的废液制备硫酸锌晶体,其流程如下:
实验室用粗锌(含铅等杂质)与过量的稀硫酸反应制氢气的废液制备硫酸锌晶体,其流程如下: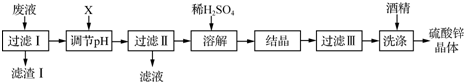
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.6 | 47.5 | 53.8 | 61.3 | 70.5 | 75.4 | 71.1 | 60.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与浓硫酸和浓硝酸的混合物反应生成邻硝基甲苯和对硝基甲苯 | |
| B. | 甲苯能使溴水褪色 | |
| C. | 甲苯燃烧产生带浓烟的火焰 | |
| D. | 1 mol甲苯与3 molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用图分离两种互溶但沸点相差较大的液体混合物 | |
| B. |  用图所示装置可除去NO2中的NO | |
| C. |  用图检验铁粉与水蒸气反应产生的氢气 | |
| D. | 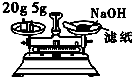 用图称量氢氧化钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 适当加热CH3COONa溶液,c(OH-)会增大 | |
| B. | 0.10mol/L的CH3COOH溶液稀释10倍后:pH=2 | |
| C. | 0.10mol/L的CH3COONa溶液中:c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH) | |
| D. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,溶液呈酸性:c(CH3COO-)<c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com