
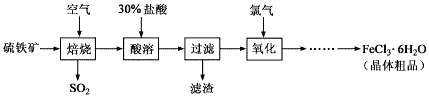
【题目】以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
(1)回答下列问题:在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g)![]() 2SO3(g),该反应的平衡常数表达式为K=______;过量的SO2与NaOH溶液反应生成亚硫酸氢钠,请解释亚硫酸氢钠溶液呈酸性的原因____。
2SO3(g),该反应的平衡常数表达式为K=______;过量的SO2与NaOH溶液反应生成亚硫酸氢钠,请解释亚硫酸氢钠溶液呈酸性的原因____。
(2)酸溶及后续过程中均需保持盐酸过量,其目的分别是____、_____。
(3)加热FeCl3·6H2O晶体,得到无水FeCl3需在干燥的HCl气流中进行,否则得到的产物为____。
(4)自来水厂同时用氯气和绿矾(FeSO4·7H2O)进行消毒、净化水,其原理是(用离子方程式表示)___________,__________,和Fe3++3H2O![]() Fe(OH)3(胶体)+3H+。
Fe(OH)3(胶体)+3H+。
【答案】![]() HSO3-的电离程度大于水解程度 提高铁元素的浸出率 抑制Fe3+水解 Fe(OH)3(Fe2O3或Fe(OH)3或Fe2O3) Cl2+H2O
HSO3-的电离程度大于水解程度 提高铁元素的浸出率 抑制Fe3+水解 Fe(OH)3(Fe2O3或Fe(OH)3或Fe2O3) Cl2+H2O![]() HClO+H++Cl- Cl2+2Fe2+=2Cl-+2Fe3+
HClO+H++Cl- Cl2+2Fe2+=2Cl-+2Fe3+
【解析】
(1)在一定条件下,SO2转化为SO3的反应为2SO2+O2![]() 2SO3,该反应的平衡常数表达式为K=
2SO3,该反应的平衡常数表达式为K=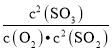 ;
;
过量的SO2与NaOH溶液反应的化学方程式为:SO2+NaOH=NaHSO3,HSO3-的电离程度大于水解程度,溶液呈酸性;
(2)酸溶及后续过程中均需保持盐酸过量,其目的是使氧化铁溶解为氯化铁,抑制铁离子的水解;
故答案为:提高铁元素的浸出率;抑制Fe3+水解;
(3)加热FeCl3·6H2O晶体,得到无水FeCl3需在干燥的HCl气流中进行,否则FeCl3会发生水解反应,即3Fe3++3H2O![]() Fe(OH)3+3H+,且盐酸易挥发,若灼烧则Fe(OH)3分解生成Fe2O3,故最后得到的产物为Fe(OH)3(Fe2O3或Fe(OH)3或Fe2O3);
Fe(OH)3+3H+,且盐酸易挥发,若灼烧则Fe(OH)3分解生成Fe2O3,故最后得到的产物为Fe(OH)3(Fe2O3或Fe(OH)3或Fe2O3);
(4)自来水厂同时用氯气和绿矾(FeSO4·7H2O)进行消毒、净化水,其原理是Cl2+H2O![]() HClO+H++Cl-,Cl2+2Fe2+=2Cl-+2Fe3+,和Fe3++3H2O
HClO+H++Cl-,Cl2+2Fe2+=2Cl-+2Fe3+,和Fe3++3H2O![]() Fe(OH)3(胶体)+3H+。
Fe(OH)3(胶体)+3H+。


科目:高中化学 来源: 题型:
【题目】(1)珊瑚礁是珊瑚虫吸收海水中的钙和二氧化碳,然后分泌出石灰石,经过以后的压实、石化形成的礁石。珊瑚礁的主要成分是________(填化学式),近年来珊瑚礁受海水侵蚀,退化严重,请写出海水侵蚀珊瑚礁的化学方程式:_____________________。
(2)下图为一定量饱和Ca(OH)2溶液中通入CO2气体后,产生CaCO3白色沉淀的质量与通入的CO2体积之间的关系曲线。请回答:
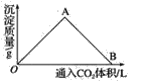
①OA段曲线所表示的化学反应方程式:_____________,A点处已参加反应的CO2与Ca(OH)2的物质的量之比为________。
②B处溶液中存在的浓度较大的两种离子是________和________(填离子符号),将B处生成的溶液煮沸,可见到的现象是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属钠的性质,实验如下:
实验装置 | 实验方案 | |
液体a | 现象 | |
| 蒸馏水 | I.钠浮在水面,剧烈反应,有少量白雾 |
0.1 mol·L-1盐酸 | II.钠浮在液面,反应比Ⅰ剧烈,有白雾产生 | |
浓盐酸 | III.钠浮在液面,反应比Ⅰ缓慢,产生大量白雾,烧杯底部有白色固体 | |
下列说法不正确的是
A.II中反应的离子方程式为2Na + 2H+ === 2Na+ + H2↑
B.对比I、II、III可知,随着c(H+) 增大,反应的剧烈程度增大
C.实验I、II、III均有白雾产生,说明Na与水或酸反应均放出大量热
D.推测III中浓盐酸的c(Cl-)以及生成的NaCl固体对反应剧烈程度有影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题。
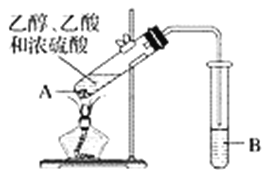
(1)试管A混合溶液的加入顺序是__________________________________。
(2)试管A中加入几块碎瓷片的目的是______________________。
(3)试管A中发生反应的化学方程式为______________,反应类型是__________。
(4)反应开始前,试管B中盛放的溶液是_______________________。
(5)试管B中可能观察到的现象是______________________________。
(6)将试管B中的物质分离得到乙酸乙酯,必须使用的仪器是________,具体操作是将乙酸乙酯从该仪器的________________________(填“下口放出”或“上口倒出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的恒容密闭容器中,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A. 容器内n(A2):n(B2):n(AB)=1:1:2
B. 容器内气体的密度不随时间变化
C. 容器内气体的总压强不随时间变化
D. 单位时间内生成2n mol AB,同时生成n mol A2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,不能达到相应实验目的的是
A | B | C | D | |
方 案 |
|
|
|
|
目 的 | 验证不同催化剂对化学反应速率的影响 | 验证石蜡油分解的产物中含有与烷烃性质不同的烃 | 除去乙烯、甲烷混合气中的乙烯 | 比较Cl2、I2的氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蔥醌(AQDS)是一种具有氧化还原活性的廉价有机分子,蔥醌/碘化铵液流可充电电池(如图)以其环保、价廉、稳定等优点被研究及广泛应用。充电时,AQDS转化为AQDS (NH4)2。 下列说法错误的是
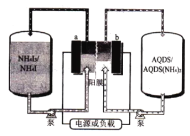
A.放电时 ,b极电势低于a极
B.充电时,a极的电极反应式为:3I--2e-= I3-
C.充电时,电路中每转移1 mole-, 膜两侧电解液的质量变化差为36 g
D.该装置中的阳膜也可以用阴膜代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容密闭容器中发生反应C(s)+H2O(g)![]() CO(g)+H2(g),下列状态中不能表明该反应达到平衡状态的是( )
CO(g)+H2(g),下列状态中不能表明该反应达到平衡状态的是( )
A.断裂氢氧键速率是断裂氢氢键速率的2倍
B.混合气体平均相对分子质量不再改变
C.单位时间内消耗水与生成氢气的质量比为9∶1
D.混合气体的物质的量不再发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com