
| A. | 由SO2制亚硫酸钠:SO2$\stackrel{Na_{2}CO_{3}溶液}{→}$NaHSO3溶液$→_{调节溶液的pH}^{NaOH溶液}$Na2SO3溶液 | |
| B. | 由NaCl制漂白粉精:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{澄清石灰水}{→}$漂粉精 | |
| C. | 由NH3制硝酸:NH3$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| D. | 由乙烯制乙酸:H2C=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{△}^{CuO_{2}}$CH3CHO |
分析 A.亚硫酸酸性比碳酸强,SO2可与碳酸钠反应生成NaHSO3,进而与NaOH反应生成Na2SO3;
B.澄清石灰水浓度较低,应用石灰乳;
C.氨气被氧化生成NO;
D.反应不完全,没有生成乙酸.
解答 解:A.亚硫酸酸性比碳酸强,SO2可与碳酸钠反应生成NaHSO3,进而与NaOH反应生成Na2SO3,故A正确;
B.澄清石灰水浓度较低,生成次氯酸钙较少,应用石灰乳,故B错误;
C.氨气被氧化生成NO,不能生成NO2,故C错误;
D.反应不完全,没有生成乙酸,故D错误.
故选A.
点评 本题综合考查元素化合物知识,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,难度不大,注意相关基础知识的积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 通入足量CO2后的溶液中:Na+、SO32-、CH3COO-、HCO3- | |
| B. | 无色溶液中:Mg2+、MnO4-、SO42-、K+ | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Fe2+、NO3-、Cl- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O2与18O2互为同位素,它们的性质基本相同 | |
| B. | 多糖、油脂、蛋白质在一定条件都能发生水解反应 | |
| C. | 玻璃、陶瓷、水泥都是硅酸盐产品,属于无机非金属材料 | |
| D. | 高纯硅广泛应用于太阳能电池、计算机芯片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 惰性电极电解氯化钾溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 能溶解Fe(OH)3的溶液中含有:HCO3-、Na+、Mg2+、Cl- | |
| C. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- | |
| D. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力开发新能源和可再生能源 | |
| B. | 城市大力发展轨道交通,少开私家车 | |
| C. | 清洁燃煤、提高燃油质量 | |
| D. | 学校、家庭安装空气净化装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向浓度为0.1mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| B | 溴乙烷与NaOH溶液共热后,滴加AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷未水解 |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈红色 | 原溶液中不含K+ |
| D | 某盐溶于盐酸,产生无色无味气体通入澄清石灰水 | 变浑浊 | 说明该盐是碳酸盐 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol苯分子中含有双键数为0.3NA | |
| B. | 1L1mol•L-1碳酸钠溶液中阴离子的数目大于NA | |
| C. | 标准状况下,22.4L乙烷中共含有分子数为NA | |
| D. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,转移的电子的数目为0.92NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如图所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶 | |
| B. | 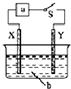 如图所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a | |
| C. | 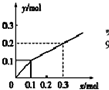 Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图,离子氧化能力M+>N3+>H+ | |
| D. | 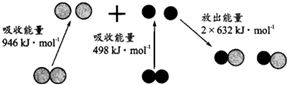 如图为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)═2NO(g)△H=-180 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com