
 向甲、乙两个容积均为1L的恒容容器中,分别通入2mol A、2mol B和1mol A、1mol B.相同条件下,发生反应:A(g)+B(g)?xC(g)△H<0,测得两容器中c(A) 随时间t的变化如图.下列说法正确的是
向甲、乙两个容积均为1L的恒容容器中,分别通入2mol A、2mol B和1mol A、1mol B.相同条件下,发生反应:A(g)+B(g)?xC(g)△H<0,测得两容器中c(A) 随时间t的变化如图.下列说法正确的是| A、x等于2 |
| B、向平衡后的乙容器中充入氦气可使c(A)增大 |
| C、将甲容器单独升温可使甲容器内各物质的体积分数与乙容器内的相同 |
| D、若向甲中再充2mol A、2mol B,则平衡时甲中c(A)>1.56mol/L |
| 2mol-0.78mol |
| 2mol |
| 0.5mol |
| 1mol |
| 2mol-0.78mol |
| 2mol |
| 0.5mol |
| 1mol |


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
| A、①② | B、①③ |
| C、①④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、常温下,1L 0.1mol?L-1的NH4NO3溶液中NH
| ||
| B、常温下,4.4g CO2和N2O混合物中所含有的原子数为0.3NA | ||
| C、标准状况下,2.24L乙烷中含有的非极性键数为0.7NA | ||
| D、1molCl2与足量的氢氧化钠溶液反应转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应不一定都有反应热 |
| B、使用催化剂可以改变反应的平衡常数 |
| C、升高温度使反应加快,是因为降低了反应的活化能 |
| D、对于同一个化学反应无论是一步完成还是分几步完成,其反应的焓变相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3- |
| B、0.1mol?L-1AgNO3 溶液:H+、K+、SO42-、I- |
| C、使紫色石蕊试液变红色的溶液:Mg2+、K+、SO42-、NO3- |
| D、0.1mol?L-1NaAlO2 溶液:H+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
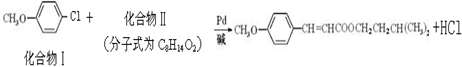

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com