
【题目】2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。请回答下列问题:

(1)该反应通常用V2O5作催化剂加快反应的进行,加V2O5会使图中B点______(填“升高”或“降低”)。
(2)E的大小对该反应的反应热有无影响且理由是_______。
(3)图中A表示SO2(g)和O2(g) 的_________。图中△H的意义是__________。
(4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物,四价钒化合物再被氧气氧化。写出该催化过程实际发生反应的化学方程式__________;V2O5对该反应进行的程度有无影响 _____________
(5)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=________。
【答案】降低无影响,因为反应热△H=正反应活化能-逆反应活化能,△H是个差值总能量 2molSO2(g)与 1molO2完全反应生成2molSO3(g)时,反应放出的热量V2O5+ SO2=SO3+2VO2 4VO2+O2=2 V2O5能够加快反应速率0.025 mol·L-1·min-1
【解析】
(1)该反应为放热反应,反应物的总能量高于生成物的总能量,则A为反应物能量,C为生成物能量;该反应通常用V2O5作催化剂加快反应的进行,加V2O5可改变反应的历程,降低活化能。
(2)反应热△H=正反应活化能-逆反应活化能,△H是个差值,因此E的大小对该反应的反应热无影响。
(3)图中A表示SO2(g)和O2(g) 的总能量,C为SO3(g)总能量;反应热△H意义是2molSO2(g)与 1molO2完全反应生成2molSO3(g)时,反应放出的热量。
(4)V2O5为催化加,可以参加反应,但是反应前后质量和化学性质保持不变,但可以加快反应速率,据题给信息进行书写方程式。
(5)根据速率之比等于化学计量数之比可计算得υ(O2)。
(1)该反应为放热反应,反应物的总能量高于生成物的总能量,则A为反应物能量,C为生成物能量;该反应通常用V2O5作催化剂加快反应的进行,加V2O5可改变反应的历程,降低活化能。图中B点会降低;正确答案:降低。
(2)反应热△H=正反应活化能-逆反应活化能,△H是个差值,因此E的大小对该反应的反应热无影响;正确答案:无影响,因为反应热△H=正反应活化能-逆反应活化能,△H是个差值。
(3)图中A表示反应物SO2(g)和O2(g) 的总能量;图中△H的意义是2molSO2(g)与 1molO2完全反应生成2molSO3(g)时,反应放出的热量;正确答案:总能量;2molSO2(g)与 1molO2完全反应生成2molSO3(g)时,反应放出的热量。
(4)根据题给信息可知:V2O5+ SO2=SO3+2VO2;4VO2+O2=2 V2O5;V2O5参加反应,能够加快该反应的反应速率,但是反应前后质量和化学性质保持不变,它为该反应的催化剂;正确答案:V2O5+ SO2=SO3+2VO2;4VO2+O2=2 V2O5;能够加快反应速率。
(5)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,根据速率之比等于化学计量数之比可计算得υ(O2)=1/2 v(SO2)=0.025 mol·L-1·min-1;正确答案:0.025 mol·L-1·min-1。


科目:高中化学 来源: 题型:
【题目】氨基甲酸铵分解反应为NH2COONH4(s)![]() 2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
A. 密闭容器中氨气的体积分数不变
B. 1 mol NH2COONH4分解同时有17g NH3消耗
C. 密闭容器中混合气体的密度不变
D. 混合气体的平均分子量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同容器中,不同条件下进行合成氨反应。根据在相同时间内测定的结果判断生成氨的速率最快的是( )
A. v(N2)=0.1mol·L-1·s-1 B. v(H2)=0.1mol·L-1·min-1
C. v(NH3)=0.15mol·L-1·min-1 D. v(H2)=0.3mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物与人类生活密不可分,生活中的一些问题常涉及化学知识。
(1)有下列几种食品:

①花生油中所含人体所需的主要营养物质为___________(填“糖类”、“油脂”或“蛋白质”)。
②吃饭时,咀嚼米饭一会儿后感觉有甜味,是因为淀粉发生了_____________(填字母)反应。
A.分解 B.水解 C.裂解
(2)在日常生活中,下列做法错误的是________。
A.用燃烧法鉴别毛织品和棉织品
B.用纯碱洗涤锅盖上的油渍
C.用闻气味的方法鉴别白酒和米醋
D.用淀粉溶液鉴别加碘食盐和不含碘的食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种无色溶液,它们分别为葡萄糖溶液、蔗糖溶液、淀粉溶液中的一种,经实验可知:
①B能发生银镜反应;②A遇碘水变蓝色;③A、C均能发生水解反应,水解液均能发生银镜反应。
(1)试判断它们各是什么物质:
A是________,B是________,C是________。
(2)分别写出A、C发生水解反应的化学方程式:
A:___________________________。
C:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是( )
A.苯与浓硝酸、浓硫酸共热并保持50~60 ℃反应生成硝基苯
B.苯乙烯(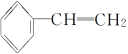 )在合适条件下催化加氢可生成乙基环己烷(
)在合适条件下催化加氢可生成乙基环己烷(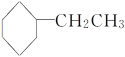 )
)
C.乙烯与溴的四氯化碳溶液反应生成1,2二溴乙烷
D.甲苯(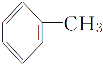 )与氯气在光照条件下反应主要生成2,4二氯甲苯(
)与氯气在光照条件下反应主要生成2,4二氯甲苯( )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态烃的分子式为CmHn,相对分子质量为H2的39倍。它不能使酸性KMnO4溶液褪色,不能同溴的四氯化碳溶液反应而使其褪色。在催化剂存在时,7.8 g 该烃能与0.3 mol H2发生加成反应生成相应的饱和烃CmHp。则:
(1)m、n、p的值分别是m=________,n=________,p=________。
(2)CmHp的结构简式是:________。
(3)CmHn能和浓硫酸、浓硝酸的混合酸反应,该反应的化学方程式是________________,该反应属于__________反应,有机产物的名称是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醛(在水中溶解度不大,易溶于有机溶剂,密度约等于水的密度)、苯甲酸。反应原理如下:
2C6H5CHO+NaOH![]() C6H5CH2OH+C6H5COONa
C6H5CH2OH+C6H5COONa
C6H5COONa+HCl![]() C6H5COOH+NaCl
C6H5COOH+NaCl
相关物质物理性质如下表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | -15 | 122 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21g | 0.34g | 5.9g |
实验流程如下:

(1)第Ⅰ步需连续加热1小时(如图1),其中加热混合固定装置为画出。
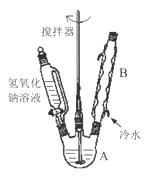
仪器A的名称为_______,若将仪器B改为仪器C,效果不如B,说明原因:_______。
(2)操作②有关分液漏斗的使用不正确的是_______
A.分液漏斗在使用之前必须检验是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时待下层液体放完后立即关闭旋塞,换掉烧杯再打开旋塞使上层液体流下
(3)操作③是用沸水浴加热蒸馏,再进行操作④(如图2),收集______℃的馏分。图2中有一处明显错误,正确的应改为_____________。
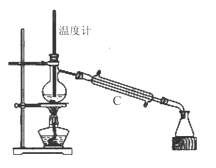
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用_____冲洗杯壁上残留的晶体。抽滤完成后用少量冰水对晶体进行洗涤,洗涤应____________。
(5)用电子天平准确称取0.2440g苯甲酸于锥形瓶中加100mL蒸馏水溶解(必要时可以加热),再用0.1000mol/L的标准氢氧化钠溶液滴定,共消耗标准氢氧化钠溶液19.20mL,苯甲酸的纯度为_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】走进化学变化的微观世界,有利于进一步认识化学变化。下图是某化学变化的微观示意图,X、Y、Z分别表示不同类别的原子,据图回答问题:

反应前 反应后
(1)该化学反应中生成物的分子个数比为______________;
(2)从微观角度分析,化学反应前后各物质的质量总和相等的原因是__________________________________________________________;
(3)该化学反应的基本类型为_________________________________;
(4)由X原子构成的物质在该反应中____________(填“是”或“不是”)催化剂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com