
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 熵值增大的反应都能自发进行 | |
| C. | 由能量判据和熵判据组合而成的复合判据,适合于所有的反应 | |
| D. | 同一物质的固、液、气三种状态的熵值相同 |
分析 A、反应自发进行的判断依据为△G=△H-T•△S;
B、反应自发进行的判断依据为△G=△H-T•△S;
C.根据△G=△H-T•△S判断;
D.同一物质的固、液、气三种状态的熵值依次增大.
解答 解:在给定的条件下,无须外界做功,一经引发即能自动进行的化学反应,为自发反应.从热力学上判断就是:△G=△H-△ST<0.
A.反应能否自发取决于焓变和熵变的复合判据,对于吸热反应,在一定温度下也能进行,故A错误;
B、△H>0,△S>0能否自发进行,取决于反应的温度,故B错误;
C.△G=△H-T•△S<0时,反应能自发进行,适合于所有的反应,故C正确;
D.同一物质的固、液、气三种状态的熵值依次增大,故D错误;
故选C.
点评 本题考查反应热与焓变,题目难度不大,注意把握相关概念的理解.


 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -Y kJ/mol | B. | -(5X-0.5Y)kJ/mol | C. | -(10X-Y)kJ/mol | D. | +(10X-Y)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
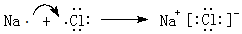 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
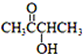 )有如下转化关系,且 1mol B反应生成了2mol C.
)有如下转化关系,且 1mol B反应生成了2mol C.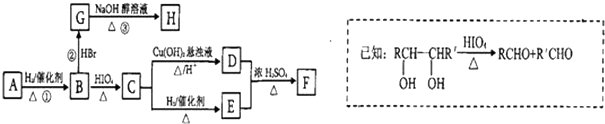
 .
.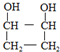 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
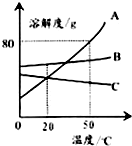
| A. | 50℃时A物质的溶解度最大 | |
| B. | 升温可使C物质的不饱和溶液变成饱和溶液 | |
| C. | 50℃时把90gA物质放入100g水中能得到190g溶液 | |
| D. | 将50℃三种物质的饱和溶液分别降温到20℃时,B溶液溶质质量分数最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||||||
| Y | Z | W |
| A. | 工业上电解ZW3饱和溶液冶炼金属Z | |
| B. | 元素X的最高正价与W的最高正价相同 | |
| C. | 简单离子半径的大小顺序:r(X-)<r(Y+) | |
| D. | Y、W的最高价氧化物的水化物均能溶解金属Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收10m3SO2就会放出5m3CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com