
| A. | 锌是阴极,氧化银是阳极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向Ag2O极移动,K+、H+向Zn极移动 | |
| D. | 随着电极反应的不断进行,电解质溶液的pH基本保持不变 |
分析 原电池放电时,较活泼的金属作负极,负极上失电子发生氧化反应,正极上得电子发生还原反应,电解质溶液中阳离子向正极移动,阴离子向负极移动,根据电极反应式判断电解质的物质的量是否变化.
解答 解:A、该原电池放电时,较活泼的金属锌是负极,氧化银是正极,故A错误;
B、根据电极反应式知,锌失电子发生氧化反应,氧化银得电子发生还原反应,故B错误;
C、原电池放电时,溶液中阳离子向正极移动,阴离子向负极移动,故C错误;
D、根据电池反应式Ag2O+H2O+Zn═Zn(OH)2+2Ag知,氢氧根离子在电池反应式中不参加,所以电解质的物质的量保持不变,故D正确.
故选:D.
点评 本题考查了原电池原理,难度不大,易错选项是C,注意原电池放电时,溶液中阳离子向正极移动,阴离子向负极移动.


科目:高中化学 来源: 题型:解答题
 实验室需要配制0.1 mol•L-1NaOH溶液500 mL,回答下列问题
实验室需要配制0.1 mol•L-1NaOH溶液500 mL,回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式:${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{C}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ | |
| B. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | |
| C. | NH4Cl的电子式: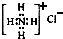 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐析可提纯蛋白质并保持其生理活性 | |
| B. | 油脂碱性或者酸性条件下的水解反应叫做皂化反应 | |
| C. | 打针时用75%的乙醇溶液消毒是蛋白质变性知识的应用 | |
| D. | 蛋白质、纤维素、淀粉都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D>A>B>C | B. | A>D>B>C | C. | D>A>C>B | D. | C>B>A>D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
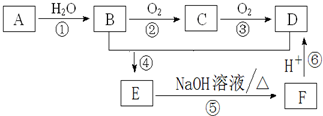 已知:烃 A的摩尔质量为28g/mol,有关A的转化关系如图所示,请回答下列问题:
已知:烃 A的摩尔质量为28g/mol,有关A的转化关系如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
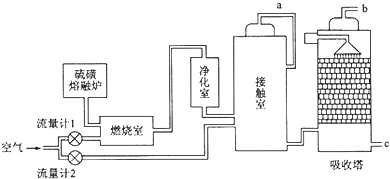
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与氢气可以发生加成反应 | B. | 甲苯燃烧带有浓厚的黑烟 | ||
| C. | 甲苯能使酸性高锰酸钾溶液褪色 | D. | 甲苯硝化生成三硝基甲苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com