
【题目】下列关于电子式的表述正确的是( )
A.HClO的电子式为
B.SCl2的电子式为
C.用电子式表示HCl的形成过程为
![]()
D.已知SCN-每个原子都达到8电子结构,则其电子式为
科目:高中化学 来源: 题型:
【题目】一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O![]() CH3COOH+4H+。下列有关说法正确的是 ( )
CH3COOH+4H+。下列有关说法正确的是 ( )
A. 电池反应的化学方程式为CH3CH2OH+O2![]() CH3COOH+H2O
CH3COOH+H2O
B. 若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
C. 检测时,电解质溶液中的H+向负极移动
D. 正极上发生的反应为O2+4e-+2H2O![]() 4OH-
4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学用 NaHCO3和KHCO3组成的某均匀混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
实验序号 | I | II | III |
盐酸体积(mL) | 100.0 | 100.0 | 100.0 |
样品质量/g | 9.2 | 15.7 | 27.6 |
CO2体积/L (标准状况) | 2.24 | 3.36 | 3.36 |
(1)该盐酸的物质的量浓度为______mol·Lˉ1
(2)使盐酸恰好完全反应,所需要的样品质量为______g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 Q、R、T、W 在元素周期表中的位置如图所示,其中 T 所处的周期数与主族序数相等。
![]()
(1)W 在周期表中的位置是_______,Q、R、T 三种元素原子半径由大到小的顺序为_______________________(用元素符号表示),Q 的最高价氧化物的化学式为________________,
(2)元素的原子得电子 能力:Q________________W(填“强于”或“弱于”)。
(3)原子序数比 R 多 1 的元素有一种氢化物能分解为它的另一种氢化物,该反应的化学方程式为______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
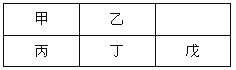
A. 原子半径:丙<丁<戊B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图所示。R原子最外层电子数Q原子最外层电子数的4倍,Q的简单离子核外电子排布与Z2-相同。下列相关叙述不正确的是

A. 化合物![]() 中含有离子键
中含有离子键
B. 五种元素中Q的金属性最强
C. 气态氢化物的稳定性:![]()
D. 最高价氧化物对应的水化物酸性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主要用于高分子胶囊和印刷油墨的粘合剂的甲基两烯酸缩水油酯GMA(即:![]() )的合成路线如下(部分反应所需试剂和条件已略去):
)的合成路线如下(部分反应所需试剂和条件已略去):

已知:
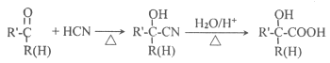
请按要求回答下列问题:
(1)GMA的分子式______________________;B中的官能团名称:______________________;甘油的系统命名:______________________。
(2)验证D中所含官能团各类的实验设计中,所需试剂有______________________。
(3)写出下列反应的化学方程式:反应⑤:____________________。反应⑧:______________________。
(4)M是H的同分异构体。M有多种同分异构体,写出满足下述所有条件的M的所有可能的结构:____________________________。
①能发生银镜反应 ②能使溴的四氯化碳溶液褪色 ③能在一定条件下水解
(5)已知: { 2 }![]()
![]()
![]() 。参照上述合成路线并结合此信息,以丙烯为原料,完善下列合成有机物C的路线流程图:丙烯
。参照上述合成路线并结合此信息,以丙烯为原料,完善下列合成有机物C的路线流程图:丙烯![]() Br
Br![]() ________________________。
________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将![]() 溶液分别滴加到浓度均为
溶液分别滴加到浓度均为![]() 的
的![]() 溶液中,所得的沉淀溶解平衡曲线如图所示(
溶液中,所得的沉淀溶解平衡曲线如图所示(![]() 用
用![]() 表示,不考虑
表示,不考虑![]() 的水解)。下列叙述正确的是( )。
的水解)。下列叙述正确的是( )。

A. ![]() 的数量级为
的数量级为![]()
B. ![]() 点对应的
点对应的![]() 溶液为不饱和溶液
溶液为不饱和溶液
C. 所用![]() 溶液的浓度为
溶液的浓度为![]()
D. ![]() 平衡常数为
平衡常数为![]() ,反应趋于完全
,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】产自我国西北某盐湖的“块碱”是一种Na2CO3和NaCl的混合物。可通过以下方法对块碱样品的组成和含量进行分析测定。
Ⅰ.定性测定NaCl的存在:
(1)取样品少许溶于水,加入足量稀硝酸充分反应后再滴加_________________溶液,能观察到有_______________________产生,说明块碱中含有NaCl。
Ⅱ.定量测定Na2CO3的含量:
准确称量w g样品置于如下装置中,向其中加入足量稀硫酸,通过测定生成气体的体积来求算Na2CO3的含量。请回答下列相关问题:

(2)测定装置中,导管a的作用是___________________________________________。
(3)为提高测定的准确度,溶液b最宜选用___________________________________。
①饱和食盐水 ②饱和NaHCO3溶液 ③澄清石灰水 ④酸性KMnO4溶液
(4)若根据所取样品的质量估计反应时产生的气体体积最多在30mL左右,则产生气体前对量气装置读数时,装置内的装液量和液面调节最为合理的是_______________________(填虚线框中对应这的字母编号)。
(5)用你以上所选出的最为合理的读数为起点,若终点读数为17.60mL,则反应所产生的气体的测定体积为_____________mL。若实验温度下的气体摩尔体积为VmL.mol-1,由此可得出样品中Na2CO3的含量表达式为: __________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com