
【题目】NH4Al(SO4)2·12H2O (铵明矾) 可用作泡沫灭火器的内留剂、石油脱色剂等。用氧化铁和铝粉等物质做铝热反应后的铝灰及硫酸铵等为原料制备铵明矾的实验步骤如下:
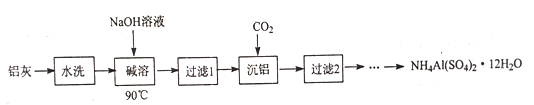
(1) 铝灰用“水洗”的目的是______碱溶时,需在约90℃条件下进行,适宜的加热方式为_____。
(2)“过滤1”所得滤渣主要成分为_________。
(3)用下图左边装置制备CO2时,适宜的药品A 为________、B 为__________;“沉铝”时,通入过量CO2 发生反应的离子方程式为________。
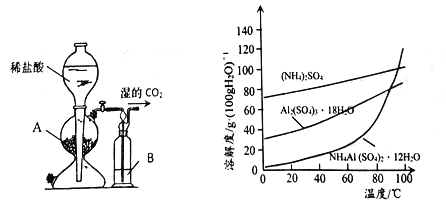
(4)请设计从“过滤2”所得滤渣制取铵明矾的实验方案: 称取一定质量“过滤2”的滤渣,放入烧杯中,____,静置,过滤、洗涤、晾干,得到NH4Al(SO4)2·12H2O [实验中须使用到3mol/L硫酸、(NH4)2SO4、蒸馏水、氨水、pH 试纸; 已知: NH4Al(SO4)2饱和溶液的pH约为1.5,几种物质的溶解度曲线见右上图]。
【答案】 除去KCl等可溶性杂质 水浴加热 Fe等 饱和NaHCO3溶液 块状石灰石(或大理石、CaCO3等) AlO2- +CO2+2H2O= Al(OH)3↓+HCO3- 加入适量蒸馏水,加热并在不断搅拌下加入3mol/L硫酸至沉淀恰好完全溶解,再加入计算量的(NH4)2SO4,用3mol/L硫酸和氨水调节溶液的PH 在1~2之间,蒸发浓縮,冷却结品
【解析】铝灰水洗的目的是洗去表面可溶性杂质,在90℃水浴条件下,用NaOH溶液进行溶解,Al2O3+2OH-=2AlO2-+H2O,过滤除去铁等不溶性杂质,向滤液中通入CO2, AlO2- +CO2+2H2O= Al(OH)3↓+HCO3- ,提纯得到较纯的Al(OH)3再制备NH4Al(SO4)2。
(1) 铝灰用“水洗”的目的是除去KCl等可溶性杂质,碱溶时,需在约90℃条件下进行,适宜的加热方式为90℃水浴加热;(2)“过滤1”所得滤渣主要成分为铁等不溶杂质;(3)制备CO2时,适宜的药品A 为块状石灰石(或大理石、CaCO3等) 、B 为饱和NaHCO3溶液除去挥发出来的HCl;“沉铝”时,通入过量CO2 发生反应的离子方程式为AlO2- +CO2+2H2O= Al(OH)3↓+HCO3- ;(4) 称取一定质量“过滤2”的滤渣,主要成分为Al(OH)3放入烧杯中,加入适量蒸馏水,加热并在不断搅拌下加入3mol/L硫酸至沉淀恰好完全溶解,再加入计算量的(NH4)2SO4,用3mol/L硫酸和氨水调节溶液的PH 在1~2之间,蒸发浓縮,冷却结品,静置,过滤、洗涤、晾干,得到NH4Al(SO4)2·12H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A. ①②③ B. ②③④
C. ①④⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在工农业上有重要作用。
Ⅰ、在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___________。该反应为__________(填“吸热”或“放热”)反应。
(2)某温度下平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),该温度下加入1 mol CO2(g)和1 mol H2(g),充分反应,达到平衡时,CO2的转化率为______________。
(3)在800 ℃时发生上述反应,某时刻测得容器内各物质的浓度分别为c(CO2)为2 mol/L,c(H2)为1.5 mol/L,c(CO)为1 mol/L,c(H2O)为3 mol/L,则正、逆反应速率的比较为:v正___________v逆(填“>”“<”或“=”)。
Ⅱ、工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJmol-1
CH3OCH3(g)+H2O(g)═2CH3OH(g)△H2=+23.4kJmol-1
则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H3=_______________kJ·mol-1。
CH3OCH3(g)+3H2O(g)△H3=_______________kJ·mol-1。
Ⅲ、常温下用氨水吸收CO2可得到NH4HCO3溶液,在该溶液中,c(NH4+)________(填“>”、“<”或“=”)c(HCO3—);反应NH4++HCO3—+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2
NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴的化合物在磁性材料生产、电池制造、催化剂制备等方面应用非常广泛。
(1)Co2+基态核外电子排布式为_________。
(2)制备[Co(H2O)6]2+反应为(NH4)2[Co(SCN)4] +6H2O= [Co(H2O)6(SCN)2+2NH4SCN。
①配合物[Co(H2O)6]2+中与Co2+形成配位键的原子是________(填元素符号);SCN-的空间构型为________(用文字描述)。
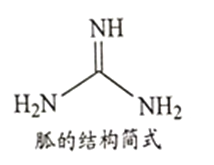
②NH4SCN在180-190℃分解并制得胍(结构简式如图所示),胍分子中氮原子杂化轨道类型为_________; 1mol 胍中含σ键数目为________。
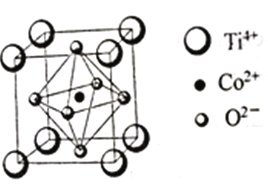
(3)一种钴的化合物可用作石油脱硫的催化剂,其晶胞结构如图所示,则晶体中与每个O2-紧邻的O2-有______个(填数字)。
乙酸异戊酯是无色透明的液体,沸点142℃,可用作食品香料。合成方法如下:
CH3COOH+HO(CH2)2CH(CH3)CH3 ![]() CH3COO(CH2)2CH(CH3)CH3+H2O
CH3COO(CH2)2CH(CH3)CH3+H2O
步骤1.称取26.4g (0.3mol) 的异戊醇和21.6g (0.36mol) 乙酸,置于三口烧瓶中,加入适量FeCl3·6H2O 和几粒沸石。
步骤2.装上温度计和仪器B (如右图),回流1h。
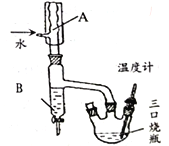
步骤3.稍冷后将仪器B 改为蒸馏装置,收集粗馏份。
步骤4.反应结束后分别用饱和食盐水、碳酸氢钠溶液和水分别洗涤、分液。
步骤5.加入2g 无水MgSO4,进一步操作得到乙酸异戊酯。
(1)图中仪器A名称为______,仪器B 的作用是_______
(2)步骤1控制投料比n(乙酸)/n(异戊醇)=1.2,其目的是__________
(3)步骤4用“碳酸氢钠溶液”洗涤的目的是_______; 分液时用到的主要玻璃仪器是______ (写名称)。
(4)步骤5 经MgSO4干燥后,_________得到乙酸异戊酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18molL﹣1浓硫酸配制100mL3.0molL﹣1稀硫酸的实验步骤如下:
(1)补充步骤
①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③溶解;④;⑤转移、洗涤; ⑥定容、摇匀; ⑦装瓶贴标签.
完成下列问题:
(2)所需浓硫酸的体积是 , 量取浓硫酸所用的量筒的规格是(从下列中选用A.10mL B.25mL C.50mL D.100mL).
(3)第③步实验的操作是 .
(4)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中;
B.容量瓶用蒸馏水洗涤后残留有少量的水;
C.所用过的烧杯、玻璃棒未洗涤;
D.定容时俯视刻度线 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种几乎不溶于水的氧化物,在涂料、玻璃等领域应用非常广泛。一种以硫化铜矿石(含CuFeS2、Cu2S 等) 为原料制取Cu2O 的工艺流程如下:
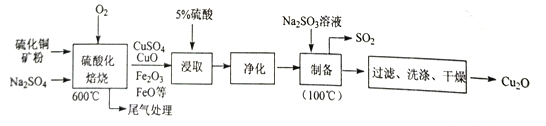
(1)“硫酸化焙烧”时:①硫化铜矿需粉碎的目的是_________;②CuS 与O2反应生成CuSO4等物质的化学方程式为________;③加入Na2SO4的作用除减小物料间黏结外,另一主要作用是__________。
(2)“浸取”时为提高铜的浸取率,除需控制硫酸的浓度外,还需控制_________ (至少列举两点)。
(3)“制备”时,溶液的pH与Cu2O 的产率关系如右图所示。
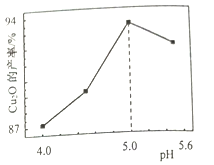
①在100℃时,发生反应的离子方程式为__________
②图中在4<pH<5 时,pH越小产率越低且产品中杂质Cu的含量越高,是因为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施能减慢化学反应速率的是( )
A. 烧煤时将煤块粉碎 B. 用锌粉替代锌粒与同浓度同体积的盐酸反应制氢气
C. 用过氧化氢溶液制氧气时添加少量二氧化锰粉末 D. 将食物贮藏在冰箱中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com