


科目:高中化学 来源: 题型:阅读理解
 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
| ||
时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | N2 | 1.00 | 1.00 |
| 4 |
| 27 |
| 4 |
| 27 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 哥本哈根会议虽未能就减排问题达成有约束力的协议,但各国对于CO2对气候的影响达成了共识,都在积极研究方法循环利用CO2.CO2(g)与H2(g)反应可生成CH3OH(g)和H2O(g).某实验小组为研究该反应进行了如下实验.在某温度下,向容积为10L的恒温恒容容器中充入a mol CO2和a mol H2,测得不同时刻的c(H2)如右表.
哥本哈根会议虽未能就减排问题达成有约束力的协议,但各国对于CO2对气候的影响达成了共识,都在积极研究方法循环利用CO2.CO2(g)与H2(g)反应可生成CH3OH(g)和H2O(g).某实验小组为研究该反应进行了如下实验.在某温度下,向容积为10L的恒温恒容容器中充入a mol CO2和a mol H2,测得不同时刻的c(H2)如右表.| 时间/min | C(H2)/mol.L-1 |
| 0 | 0.40 |
| 2 | 0.28 |
| 4 | 0.19 |
| 6 | 0.13 |
| 8 | 0.08 |
| 10 | 0.04 |
| 12 | 0.04 |
 CH3OH+H2O
CH3OH+H2O CH3OH+H2O
CH3OH+H2O| c(CH3OH) |
| c(CO2) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 时间/min | C(H2)/mol.L-1 |
| 0 | 0.40 |
| 2 | 0.28 |
| 4 | 0.19 |
| 6 | 0.13 |
| 8 | 0.08 |
| 10 | 0.04 |
| 12 | 0.04 |
| c(CH3OH) |
| c(CO2) |
查看答案和解析>>
科目:高中化学 来源:2010年湖南省长沙市浏阳一中高考化学模拟试卷(5月份)(解析版) 题型:填空题
| 时间/min | C(H2)/mol.L-1 |
| 0.40 | |
| 2 | 0.28 |
| 4 | 0.19 |
| 6 | 0.13 |
| 8 | 0.08 |
| 10 | 0.04 |
| 12 | 0.04 |
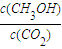 增大的是 (填字母).
增大的是 (填字母).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com