
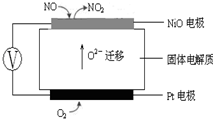
 (1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如:6Ag(s)+O3(g)=3Ag2O(s)△H1
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如:6Ag(s)+O3(g)=3Ag2O(s)△H1| 催化剂 |
| 投料比[n(NO2)/n(CH4)] | 400K | 500K | 600K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
| C(N2)×C2(H2O)×C(CO2) |
| C(CH4)×C2(NO2) |
| C(N2)×C2(H2O)×C(CO2) |
| C(CH4)×C2(NO2) |
| ||
| △ |
| 0.008mol |
| 0.014mol+0.008mol+0.006mol+0.012mol |


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
| A、自然界中存在大量的单质硅 |
| B、石英、水晶、硅石的主要成份都是二氧化硅 |
| C、二氧化硅的化学性质活泼、溶于水形成难溶的硅酸 |
| D、自然界的二氧化硅都存在在水晶矿中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol铁与0.1mol氯气点燃完全反应,转移电子数为0.3NA |
| B、0℃,101kPa时,NA个分子所占的体积一定为22.4L |
| C、1 mol?L-1K2SO4溶液中含有钾离子数为2NA |
| D、常温常压下,6.4g氧气和臭氧混合气体中含有的原子总数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组利用如图所示装置进行实验,对钢铁的电化学腐蚀原理进行探究.
某兴趣小组利用如图所示装置进行实验,对钢铁的电化学腐蚀原理进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:
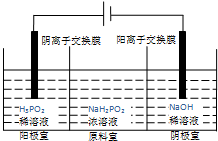 磷有多种化合物,次磷酸(H3PO2)和次磷酸钠(NaH2PO2)常为化工生产中的还原剂.
磷有多种化合物,次磷酸(H3PO2)和次磷酸钠(NaH2PO2)常为化工生产中的还原剂.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O
冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com