
【题目】大马酮是一种主要用于高级化妆品和食品的香料,可通过紫罗兰酮A以下列方法合成:
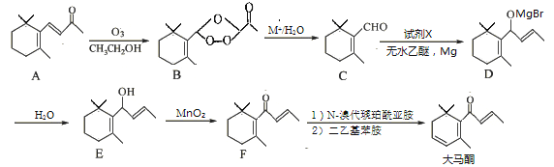
(1)B中的含氧官能团名称为 和 。
(2)D→E的反应类型为 。
(3)试剂X的分子式为C3H5Br,X的结构简式为 。
(4)写出同时满足下列条件的F的一种同分异构体的结构简式 。
①能与FeCl3溶液发生显色反应;
②分子中只有5种不同化学环境的氢。
(5)请以氯化苄![]() 和溴乙烷为原料制备苯丙烯
和溴乙烷为原料制备苯丙烯 ![]() ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
【答案】
(1)醚键 羰基 或过氧基(每个2分,共4分)
(2)取代反应(2分)
(3)CH3CH=CHBr(2分)
(4)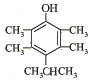 或
或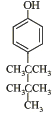 (3分)
(3分)
(5) (4分)
(4分)
【解析】
试题分析:
(1)B中含有醚键、羰基和过氧基,过氧基是不做要求的知识,故写前两个即可;
(2)氢原子取代“MgBr”,故为取代反应;
(3)根据物质C、D比较,D多了3个碳原子,结合分子式含有溴原子,即可得到X的结构简式;
(4)根据信息确定该物质含有苯环、酚羟基,去掉苯环和酚羟基外,还有碳原子7个,没有不饱和度,对称添加7个碳原子即可以得到答案;
(5)根据产物和原料分析,只需要把氯化苄和溴乙烷接在一起就可以满足碳架结构,根据流程获得C到D步可以连接碳链,官能团应为卤代烃和醛,即需要把氯化苄转化为苯甲醛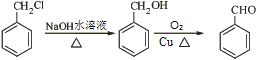 ;然后根据流程连接,水解形成羟基,消去得到产物:
;然后根据流程连接,水解形成羟基,消去得到产物: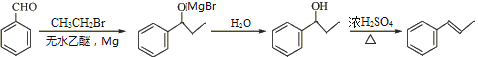 。
。


科目:高中化学 来源: 题型:
【题目】乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如下图所示:

(1)A是一种遇到碘单质能变蓝的多糖,A的分子式是_______________。
(2)物质B、C都能在加热条件下与新制的氢氧化铜反应产生砖红色沉淀,但不能发生水解反应,B中官能团的名称为____________,写出反应②的化学方程式___________________。
(3)下图是实验室通过反应①制取少量E的装置图。

实验时,加热前试管a中三种化学试剂的加入顺序依次为__________________(填名称),其中浓硫酸的作用是____________,写出试管a中生成E的化学反应方程式___________________。
(4)上述流程中C2H3Cl的结构简式____________。
(5)上述流程中标号①至④的反应中,与下列反应属同一反应类型的有______________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。
(1)常温下,可用铁或者铝制的容器盛放浓硝酸,说明浓硝酸具有_________ 性
A.酸性 B.强氧化性 C.吸水性 D.脱水性
(2)工业上用洗净的废铜屑作原料来制备硫酸铜。下列制备方法符合“绿色化学”思想的是_______________________________(填序号)。
① Cu + H2SO4(浓)![]() CuSO4 ② Cu
CuSO4 ② Cu![]() CuO
CuO![]() uSO4
uSO4
写出①中反应的化学方程式:________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】
甲基呋喃与氨在高温下反应得到甲基吡咯:

(1)Zn的基态原子核外电子排布式为 。配合物[Zn(NH3)3(H2O)]2+中,与Zn2+形成配位键的原子是 (填元素符号)。
(2)1 mol甲基呋喃分子中含有σ键的数目为 mol。
(3)甲基吡咯分子中碳原子轨道的杂化轨道类型是 。与NH3分子互为等电子体的阳离子为 。
(4)甲基吡咯的熔沸点高于甲基呋喃的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在工农业上有重要作用。
(1)水煤气是将水蒸气通过灼热的焦炭而生成的气体,水煤气的主要成分为_________
(用化学式表示);
(2)高温时,用CO还原MgSO4可制备高纯度MgO。若在750℃时,测得气体中含有等物质的量的SO2、SO3,则反应的化学方程式为____________;
(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由CO2制取碳的太阳能工艺如右图所示。

①若“重整系统”发生的反应中![]() =6,则FexOy的化学式为____________;
=6,则FexOy的化学式为____________;
②“热分解系统”中每分解1mol FexOy,转移电子的物质的量为____________。
(4)工业上用CO2和H2反应合成甲醚。
已知:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH=130.8 kJ·mol-1
CH3OCH3(g)+3H2O(g) ΔH=130.8 kJ·mol-1
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是____________(填标号)。
a.逆反应速率先增大后减小 b.反应物的体积百分含量减小
c.H2的转化率增大 d.容器中的n(CO2)/n(H2)值变小
②某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。

T1温度下,将4molCO2和8molH2充入2L的密闭容器中,5min后该反应达到平衡,则0~5min内的平均反应速率v(CH3OCH3)=______________;
KA、KB、KC三者之间的大小关系为_____________。
(5)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在该溶液中,c(NH4+)________(填“>”、“<”或“=”)c(HCO3-;反应NH4++HCO3+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________。
NH3·H2O+H2CO3的平衡常数K=__________。
(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷元素生产和生活中有广泛的应用。
(1)P原子价电子排布图为____。
(2)四(三苯基磷)钯分子结构如图1。

P原子以正四面体的形态围绕在钯原子中心上,判断该物质在水中溶解度并加以解释:_________。该物质可用于图2所示物质A的合成,物质A中碳原子杂化轨道类型为____;一个A分子中手性碳原子数目为____。
(3)在图3中表示出四(三苯基磷)钯分子中配位键____。

(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正六面体形阴离子,熔体中P-Cl的键长只有198nm和206nm两种,这两种离子的化学式为____;正四面体形阳离子中键角大于PCl3的键角原因为_____。
(5)磷有三种含氧酸H3PO2、H3PO3、H3PO4,其中磷元素均以sp3杂化与相邻原子形成四个σ键,则H3PO3的结构式是________,写出H3PO2与足量氢氧化钠溶液反应的化学方程式:____________________。磷的三种含氧酸H3PO2、H3PO3、H3PO4的酸性强弱顺序为H3PO2<H3PO3<H3PO4,其原因是_____________________。
(6)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成。
①写出合成磷化硼的化学反应方程式:____________________
②三溴化硼分子和三溴化磷分子的立体构型分别是________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学实验时,必须十分重视实验安全。下列有关实验操作不符合上述要求的是()
A. 在气体发生装置上点燃氢气等气体时,必须先检验气体的纯度
B. 加热灼烧后的坩埚放置在实验桌上冷却至室温
C. 若不小心打翻酒精灯使酒精着火时,应用湿抹布盖灭
D. 蒸馏操作过程中,若发现忘加沸石,应立即停止加热,待烧瓶冷却后再补加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com