


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源:不详 题型:填空题
| | X—Y | X=Y | X≡Y |
| BD的键能/kJ·mol-1 | 357.7 | 798.9 | 1 071.9 |
| C2的键能/kJ·mol-1 | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
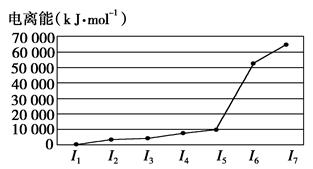
科目:高中化学 来源:不详 题型:填空题

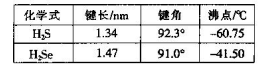
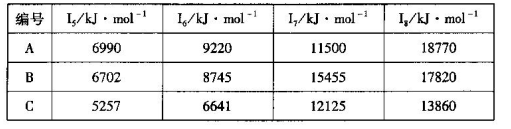
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.14N与15N为同种核素 |
| B.14N的第一电离能小于14C |
| C.15NH3与14NH3均能形成分子间氢键 |
| D.CH315NH2与CH3CH214NH2互为同系物 |
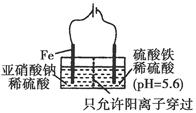
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH2、②HC≡CH、③
CH2、②HC≡CH、③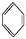 、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。
、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。 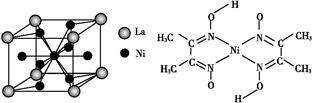
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | A | B | C | D | E |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
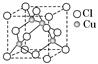
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
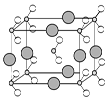
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com