
分析 (1)以硫磺为原料生产硫酸的过程为硫燃烧生成二氧化硫,二氧化硫催化氧化生成三氧化硫,三氧化硫和水反应生成硫酸;
(2)反应中锰元素化合价+2价变化为+7价,电子转移5e-,S2O82-中硫元素化合价+7价变化为SO42-中 硫元素化合价+6价,电子转移2e-,结合电子守恒和原子守恒配平书写得到反应的离子方程式,元素化合价升高的做还原剂被氧化,得到氧化产物;
(3)用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82-,HSO4-离子在阳极失电子生成S2O82-,电极反应为:2HSO4--2e-═S2O82-+2H+,结合电极反应电子守恒计算得到生成氢气的质量;
(4)已知硫酸的第二级电离并不完全,在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4-电离,溶液显酸性,则溶液中离子浓度大小为c(K+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH-),往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中c(HSO4-)、c(K+)浓度增大,但对于电离平衡,HSO4-?H++SO42-,硫酸氢根离子只电离不水解,氢离子浓度增大平衡逆向进行,电离程度减小,c(HSO4-)增大的多;
(5)已知:HSO3-?H++SO32-K=1.02×10-7,NH4++H2O?NH3•H2O+H+ K=5.65×10-10,亚硫酸氢根离子电离程度大于一水合氨的电离程度,所以亚硫酸氢铵溶液中滴入氢氧化钡溶液,氢氧根离子先和亚硫酸氢根离子反应,后与铵根离子结合生成一水合氨,反应中氢氧化钡量不同产物不同,不足量的氢氧化钡反应时需要满足化学式的组成比,
a.从选项中的离子方程式分析,HSO3-+Ba2++OH-→BaSO3↓+H2O是氢氧化钡不足量时的反应,只和亚硫酸氢根离子反应,则氢氧化钡电离出的钡离子和氢氧根离子全部反应,需要符合氢氧化钡化学式的组成比,;
b.选项中离子方程式分析,NH4++2HSO3-+2Ba2++3OH-→2BaSO3↓+2H2O+NH3•H2O,电离出2molBa2+,电离出的氢氧根离子为4mol,其中2molOH-和2mol亚硫酸氢根离子反应,2molOH-和2molNH4+离子反应,是氢氧化钡和亚硫酸氢铵1:1恰好完全反应;
c.依据b分析可知,选项中离子方程式为氢氧化钡和亚硫酸氢铵1:1反应;
d.反应是4molNH4HSO3和3molBa(OH)2的反应,6molOH-离子先和4molHSO3-反应,剩余 2molOH-离子再和2molNH4+离子反应剩余2molNH4+离子生成亚硫酸铵;
解答 解:(1)以硫磺为原料生产硫酸的过程为硫燃烧生成二氧化硫,二氧化硫催化氧化生成三氧化硫,三氧化硫和水反应生成硫酸,第一步反应的化学方程式为:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,
故答案为:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;
(2)反应中锰元素化合价+2价变化为+7价,电子转移5e-,S2O82-中硫元素化合价+7价变化为SO42-中 硫元素化合价+6价,电子转移2e-,电子转移总数为10e-,Mn2+前系数,2,S2O82-,前系数为5,结合原子守恒、电荷守恒配平书写离子方程式为:2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+,反应中锰元素化合价+2价变化为+7价,做还原剂被氧化生成氧化产物为MnO4-,
故答案为:2,5,8,2,10,16,MnO4-;
(3)用电解硫酸氢钾的方法制取过硫酸钾:阴离子在阳极失电子发生氧化反应,元素化合价分析可知硫元素化合价+6价变化为+7价,化合价升高失电子发生氧化反应生成S2O82-,HSO4-在阳极反应生成S2O82-,电极反应为:2HSO4--2e-═S2O82-+2H+,另一极生成氢气,电极反应为2H++2e-=H2↑,阳极电子守恒计算,生成0.1mol的S2O82-同时,电子转移0.2mol,S2O82-~H2↑~2e-,可收集到氢气物质的量0.1mol,质量=0.1mol×2g/mol=0.2g,
故答案为:阳极,0.2;
(4)已知硫酸的第二级电离并不完全,在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4-电离,溶液显酸性,则溶液中离子浓度大小为c(K+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH-),则该溶液中离子浓度由大到小排列第2位的离子是HSO4-,第4位的离子是SO42-,往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中c(HSO4-)、c(K+)浓度增大,但对于电离平衡,HSO4-?H++SO42-,硫酸氢根离子只电离不水解,氢离子浓度增大平衡逆向进行,电离程度减小,c(HSO4-)增大的多,$\frac{c({K}^{+})}{c(HS{{O}_{4}}^{-})}$比值减小,
故答案为:HSO4-,SO42-,减小;
(5)已知:HSO3-?H++SO32-K=1.02×10-7,NH4++H2O?NH3•H2O+H+ K=5.65×10-10,亚硫酸氢根离子电离程度大于一水合氨的电离程度,所以亚硫酸氢铵溶液中滴入氢氧化钡溶液,氢氧根离子先和亚硫酸氢根离子反应,后与铵根离子结合生成一水合氨,反应中氢氧化钡量不同产物不同,不足量的氢氧化钡反应时需要满足化学式的组成比,
a.从选项中的离子方程式分析,HSO3-+Ba2++OH-→BaSO3↓+H2O是氢氧化钡不足量时的反应,只和亚硫酸氢根离子反应,则氢氧化钡电离出的钡离子和氢氧根离子全部反应,需要符合化学式的组成比,正确的应为2HSO3-+Ba2++2OH-→BaSO3↓+2H2O+SO32-,故a错误;
b.选项中离子方程式分析,NH4++2HSO3-+2Ba2++3OH-→2BaSO3↓+2H2O+NH3•H2O,电离出2molBa2+,电离出的氢氧根离子为4mol,其中2molOH-和2mol亚硫酸氢根离子反应,2molOH-和2molNH4+离子反应,正确的反应离子方程式为:NH4++HSO3-+Ba2++2OH-→BaSO3↓+H2O+NH3•H2O,故B错误;
c.依据b分析可知,选项中离子方程式为氢氧化钡和亚硫酸氢铵1:1反应的离子方程式,NH4++HSO3-+Ba2++2OH-→BaSO3↓+H2O+NH3•H2O,故c正确;
d.2NH4++4HSO3-+3Ba2++6OH-→3BaSO3↓+4H2O+2NH3•H2O+SO32-,分析离子方程式,反应是4molNH4HSO3和3molBa(OH)2的反应,6molOH-离子先和4molHSO3-反应,剩余 2molOH-离子再和2molNH4+离子反应剩余2molNH4+离子生成亚硫酸铵,反应的离子方程式正确,故d正确,
故答案为:cd.
点评 本题考查了氧化还原反应电子转移计算和离子方程式书写,弱电解质电离平衡影响因素,和量有关的离子方程式书写和判断,注意反应的量不同产物不同,题目难度中等.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:多选题
| A. | 6.02×1023 | B. | 12C原子质量的十二分之一 | ||
| C. | 0.012Kg12C所含的原子数 | D. | 1mol氧气所含的微粒数 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
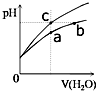 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A. | a、b、c三点溶液的离子浓度之和a>b>c | |
| B. | b点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| C. | 用等浓度的NaOH溶液和等体积b、c处溶液反应,恰好反应时消耗NaOH溶液的体积Vb=Vc | |
| D. | a、b、c三点溶液中水的电离程度a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若晶体熔融状态下能导电,该晶体一定是离子晶体 | |
| B. | 若晶体熔化时化学键断裂,该晶体一定是原子晶体 | |
| C. | 若晶体中含有非极性分子,该晶体可能有较低的熔沸点 | |
| D. | 若晶体中含有极性共价键,该晶体不可能有很高的熔沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3- | B. | SO42- | C. | Na+ | D. | H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=20 | B. | x=40 | C. | 20<x<40 | D. | x>40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
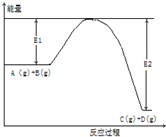 反应A(g)+B(g)?C(g)+2D(g)的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+2D(g)的能量变化如图所示,回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com