
【题目】某高分子有机物P的合成路线如下:
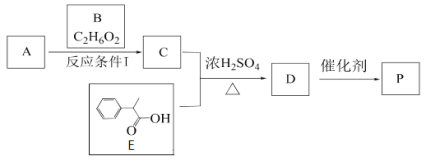
已知1 mol B与足量的金属钠反应产生标况下22.4L氢气
(1)A是2-甲基丙烯酸,A的结构简式是______________,E的化学式为___________________
(2)A和B生成C的反应类型是________,D生成P的反应类型是______________
(3)A与过量的B反应生成C,若A过量,则得到C′, C′的结构简式为__________________
(4)P用NaOH溶液处理,完全水解的化学方程式是:_________________________________________________________________
【答案】![]() C9H10O2 取代反应 加聚反应
C9H10O2 取代反应 加聚反应 ![]()
【解析】
根据1molB与足量的金属钠反应产生标况下22.4L氢气,说明B中有两个羟基或羧基,结合B的分子式可知,B为HOCH2CH2OH,A是![]() ,A与过量的B反应生成C,所以A与HOCH2CH2OH发生酯化反应生成C为
,A与过量的B反应生成C,所以A与HOCH2CH2OH发生酯化反应生成C为![]() ,C与E发生酯化反应生成D为
,C与E发生酯化反应生成D为![]() ,D在催化剂的条件下发生加聚反应生成P为
,D在催化剂的条件下发生加聚反应生成P为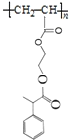 ,据此答题。
,据此答题。
(1)A是2甲基丙烯酸,A的结构简式是![]() ,根据E的结构简式可知,E的化学式为C9H10O2,故答案为:
,根据E的结构简式可知,E的化学式为C9H10O2,故答案为:![]() ; C9H10O2;
; C9H10O2;
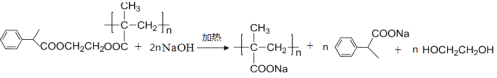
(2)根据上面的分析可知,A和B生成C的反应类型是取代反应,D生成P的反应类型是加聚反应,故答案为:取代反应;加聚反应;
(3)A与过量的B反应生成C,若A过量,则得到C′,C′的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)P为 P用NaOH溶液处理,酯基水解,完全水解的化学方程式是:
P用NaOH溶液处理,酯基水解,完全水解的化学方程式是:![]() ,故答案为:
,故答案为:![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
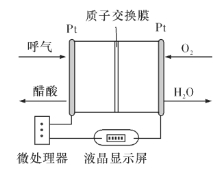
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,回答问题:
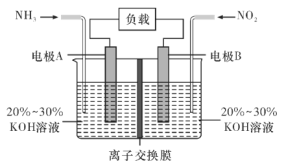
(1)电流从____(选填“左”或“右”,下同)侧电极经过负载后流向______侧电极。
(2)为使电池持续放电,离子交换膜需选用______离子交换膜(选填“阴”或“阳”)。
(3)A电极上的电极反应式为___________________________。
(4)当有4.48 L NO2(标准状况)被处理时,转移电子为________摩尔。
(5)负载可以测定电流大小,从而确定气体含量,酒驾测定工作原理与其相似。仔细阅读图:写出酒驾测定中电池总反应方程式:______________________________,负极反应方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。磷还能让心脏有规律地跳动、维持肾脏正常机能和传达神经刺激的重要物质。许多磷的化合物是工业上的重要原料。请完成下列填空:
P(s,红磷)+![]() O2(g)=
O2(g)=![]() P4O10(s)+738.5 kJ
P4O10(s)+738.5 kJ
P4(s,白磷)+ 5O2(g)=P4O10(s)+2983.2 kJ
(1)则白磷转化为红磷的热化学方程式_____________________。
(2)红磷在KOH溶液的悬浊液中和KOCl作用,可以生成K6P6O12的钾盐和KCl等产物。请写出该反应的化学方程式,并标出电子转移方向和数目。____
(3)制备MgNH4PO4时通常在镁盐(如氯化镁)溶液中加Na2HPO4 、氨水和铵盐溶液(如氯化铵),反应式为MgCl2+Na2HPO4+NH3=2NaCl+MgNH4PO4↓。在此反应中,如果不加铵盐,在碱性溶液中,Mg2+将会被氨水沉淀,其离子方程式为____________________;加入铵盐之后,可防止产生Mg(OH)2沉淀。请用电离平衡原理解释原因:_________
(4)H3PO3与碘水反应,碘水的棕黄色褪去,生成磷酸,向上述反应后的溶液中加入过量的AgNO3溶液,生成黄色沉淀。则H3PO3与碘水反应的化学方程式为___________;黄色沉淀是_________,可用作于_____________________(写出任意一种用途即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出惰性电极电解AgNO3溶液阳极的电极方程式_______________________。
(2)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
①常温下,某纯碱溶液中滴入酚酞,溶液呈红色,原因是______________________;(用离子方程式表示)
②常温下,在NH4Cl溶液中离子浓度由大到小的顺序为_____________________________;
③某温度时,水的离子积为KW=1×10-13,在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mol/L,则该溶液的pH可能为___________;
④室温下,0.1mol/L的酒石酸(H2C4H4O6)溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6)+2 c(C4H4O62)=__________mol/L。(用计算式表示)
⑤难溶电解质在水溶液中存在溶解平衡。某MgSO4溶液里c(Mg2+)=0.002molL1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于__________;(该温度下Mg(OH)2的Ksp=2×1011)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示反应 N2(g)+3H2(g)![]() 2NH3(g)+Q的正反应速率随时间的变化情况,试根据如图曲线判断下列说法可能正确的是( )
2NH3(g)+Q的正反应速率随时间的变化情况,试根据如图曲线判断下列说法可能正确的是( )
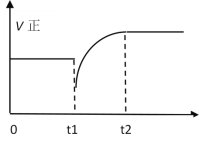
A.t1时只减小了压强
B.t1时只降低了温度
C.t1时只减小了NH3的浓度,平衡向正反应方向移动
D.t1时减小N2浓度,同时增加了NH3的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图A装置常用于实验室制备气体
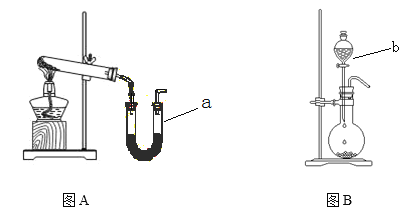
(1)写出实验室用该装置制备O2化学方程式 __________________________________。
(2)若利用该装置制备干燥NH3,试管中放置药品是_______________(填化学式);仪器 a中放置药品名称是________ 。
(3)图B装置实验室可用于制备常见的有机气体是_______。仪器b名称是_________。有学生利用图B装置用浓氨水和生石灰制备NH3,请说明该方法制取NH3的原因 。______________________________________________________________
(4)学生甲按图所示探究氨催化氧化
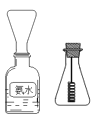
①用一只锥形瓶倒扣在浓氨水试剂瓶口收集氨气 ,然后将红热的螺旋状铜丝插入锥形瓶中;片刻,锥形瓶中气体变为红棕色。下列叙述正确的是_________
A.如图收集氨气是利用氨水的密度较小 B.锥形瓶必须干燥
C.收集氨气时间越长,红棕色现象越明显 D.铜丝能保持红热
②学生乙对学生甲的实验提出了异议,认为实验中产生的红棕色气体可能是空气中的氮气氧化后造成的,你认为学生乙的说法合理吗?请你设计一个简单实验证明学生乙的说法是否正确。_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.用乙醇或CCl4均可提取碘水中的碘单质
B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同
C.PCl3和Na2O2中各原子或离子最外层都满足8电子稳定结构
D.24Mg34S晶体中电子总数与中子总数之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol·L-1) | 10 | 4.5 | 2.5 | 1.5 | 1.0 | 1.0 |
c(CO)/(10-3mol·L-1) | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1) 已知该反应ΔS<0,在上述条件下反应能够自发进行,则反应的ΔH________0(填写“>”“<”或“=”)。
(2)前2 s内的平均反应速率v(N2)=________。
(3)在该温度下,反应的平衡常数表达式K=________。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前海水提溴的最主要方法之一是空气吹出法,其部分流程图如下:
![]()
以下推断不合理的是( )
A. 热空气能吹出溴是利用溴易挥发的性质
B. SO2吸收溴的反应方程式:SO2+2H2O+Br2=H2SO4+2HBr
C. 流程中循环利用的物质有SO2、Br2、Cl2等
D. 没有采用直接蒸馏含Br2的海水得到单质溴主要是为了节能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com