
| A. | 向淀粉水解后的溶液中加入碘水,溶液变蓝色,证明淀粉没有水解 | |
| B. | 向NaOH溶液中滴加浓度均为0.1mol•L-1的FeCl3和AlCl3混合溶液,出现红褐色沉淀,由此可知Ksp[Fe(OH)3]<Ksp[Al(OH)3] | |
| C. | 向待测试样中加入过量稀盐酸无现象,再滴加BaCl2溶液,有白色沉淀生成,证明试样中含SO42- | |
| D. | 将Fe(NO3)2样品溶于稀硫酸,再滴加KSCN溶液变为红色,证明样品已部分或全部变质 |
分析 A.溶液变蓝,只能说明淀粉没有完全水解,无法判断是否水解;
B.氢氧化铝溶于氢氧化钠,应该向氯化铝、氯化铁溶液中滴加氢氧化钠溶液;
C.先与稀盐酸排除干扰离子,然后用氯化钡溶液检验是否含有硫酸根离子;
D.酸性条件下硝酸根离子能够氧化亚铁离子,干扰了检验结果.
解答 解:A.向淀粉水解后的溶液中加入碘水,溶液变蓝色,证明淀粉没有完全水解,应该用银氨溶液或新制氢氧化铜检验是否是否水解,故A错误;
B.向NaOH溶液中滴加浓度均为0.1mol•L-1的FeCl3和AlCl3混合溶液,由于氢氧化铝溶于氢氧化钠溶液,无法比较氢氧化铝和氢氧化铁的溶度积,应该向等浓度的氯化铁、氯化铝溶液中滴加氢氧化钠溶液,故B错误;
C.向待测试样中加入过量稀盐酸无现象,排除了碳酸根离子、银离子等干扰,再滴加BaCl2溶液,有白色沉淀生成,该沉淀为硫酸钡,则可证明试样中含SO42-,故C正确;
D.将Fe(NO3)2样品溶于稀硫酸,酸性条件下硝酸根离子具有强氧化性,将亚铁离子氧化成铁离子,干扰了检验,无法判断硝酸亚铁是否变质,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握淀粉水解原理、沉淀转化、离子检验方法为解答本题的关键,侧重分析与实验能力的考查,注意化学反应原理及实验的评价性分析,题目难度不大.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:选择题
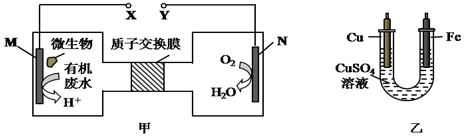
| A. | 铜电极应与Y相连接 | |
| B. | 乙装置中溶液的颜色不会变浅 | |
| C. | 当N电极消耗0.25 mol气体时,则铁电极质量增加16 g | |
| D. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
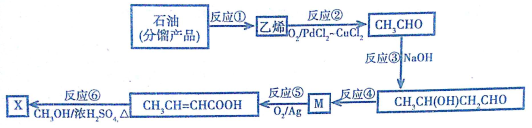
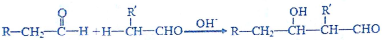
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
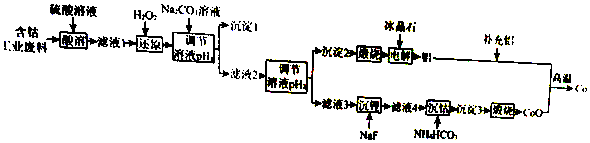
| 含钴废料的成分 | |||||
| 成分 | Al | Li | Co2O3 | Fe2O3 | 其他不溶于强酸的杂质 |
| 质量分数/% | 10.5 | 0.35 | 65.6 | 9.6 | 13.95 |
| Ⅱ.实验中部分离子开始沉淀和沉淀完全的pH | |||
| 金属离子 | Fe3+ | Co2+ | Al3+ |
| 开始沉淀的pH | 1.9 | 7.15 | 3.4 |
| 沉淀完全的pH | 3.2 | 9.15 | 4.7 |
 ]-.
]-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| 从海水中获得精制食盐 | 用液氨制冷 | 用高粱、小麦酿酒 | 用铝制容器蒸、煮腌制的咸菜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冷浓硝酸不能用铝制容器盛装 | |
| B. | 钠可从钴盐溶液中置换出钴单质 | |
| C. | 食盐中加入碘单质可以预防甲状腺肿大 | |
| D. | 光导纤维遇氢氧化钠溶液易“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肥皂水、矿泉水及食醋三种溶液的pH依次减小 | |
| B. | 高铁车厢采用的铝合金材料强度大、质量轻,不与氧气反应 | |
| C. | 食品袋中放入盛有硅胶和铁粉的透气小袋,是为了防止食物受潮、氧化变质 | |
| D. | 采用“静电除尘”、“汽车尾气催化净化”等方法可减少“雾霾”的发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
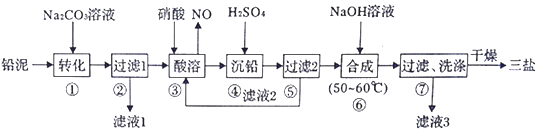
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | |||||||
| 3 | ① | ② | ④ | ⑤ | ||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com