
某厂废水中含5.00×10-3mol·L-1的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:
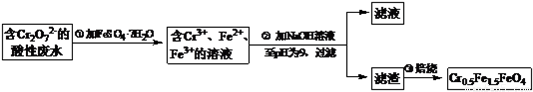
(1)第①步反应的离子方程式是____________________;
(2)第②步中用pH试纸测定溶液pH的操作是:________________;
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有____________;
(4)欲使1L该废水中Cr2O72-的完全转化为Cr0.5Fe1.5FeO4。理论上需要加入____FeSO4·7H2O。
科目:高中化学 来源:2016-2017学年重庆市高二3月月考化学试卷(解析版) 题型:选择题
除去被提纯物质中的杂质,方案不正确的是
编号 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A | 乙烯 | SO2 | NaOH溶液 | 洗气 |
B | 乙炔 | H2S、PH3 | CuSO4溶液 | 洗气 |
C | 溴苯 | Br2 | 苯 | 分液 |
D | 苯 | 甲苯 | KMnO4(酸化),NaOH溶液 | 分液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省西安市高一(文科班)下学期第一次教学检测化学试卷(解析版) 题型:选择题
碳元素有的三种原子: 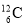 、
、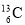 、
、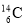 ,下列各项对三种原子均不同的是
,下列各项对三种原子均不同的是
A. 核电荷数 B. 中子数 C. 电子层数 D. 元素种类
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三毕业班联考(一)化学试卷(解析版) 题型:简答题
含氮的化合物广泛存在于自然界,是一类非常重要的化合物。回答下列有关问题:
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。已知该反应的相关的化学键键能数据如下:
化学键 | N≡N | H-O | N-H | O=O |
E/(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的ΔH=_______________kJ/mol。
(2)在恒容密闭容器中充入2molNO2与1molO2发生反应如下:
4NO2(g)+O2(g)  2N2O5(g)
2N2O5(g)
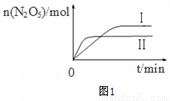
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示。常温下,该反应能逆向自发进行,原因是_______________________。
②下列有关该反应的说法正确的是___________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
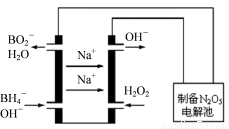
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为 _________________________。
0.01 mol/L 的溶液 | X | Y | Z | W |
pH | 12 | 2 | 8.5 | 4.5 |
X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。上表是常温下浓度均为0.01 mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各1mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为_______________________。
氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
Ⅰ:2NO2(g)+ NaCl(s) NaNO3(s)+ ClNO(g) K1
NaNO3(s)+ ClNO(g) K1
Ⅱ:2NO(g)+ Cl2(g) 2ClNO(g) K2
2ClNO(g) K2
①4NO2(g)+ 2NaCl(s) 2NaNO3(s)+ 2NO(g)+Cl2(g)的平衡常数K=_________(用K1、K2表示)
2NaNO3(s)+ 2NO(g)+Cl2(g)的平衡常数K=_________(用K1、K2表示)
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应Ⅱ达到平衡。测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=___________;其他条件不变,反应Ⅱ在恒压条件下进行,平衡时NO的转化率α2________α1(填“>” “<”或“=”)
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三毕业班联考(一)化学试卷(解析版) 题型:选择题
25℃时,下列有关电解质溶液说法正确的是( )
A. 1.0mol/L NH4HCO3溶液pH=8.0。由此可知Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B. 向氨水中加入NH4C1固体,溶液中 增大
增大
C. 向CH3COONa溶液中滴加硫酸至中性时,c(SO42ˉ)<c(CH3COOH)
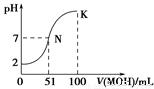
D. 下图中曲线可以表示向100mL 0.01 mol/LCH3COOH溶液中逐滴加入0.02mol/L NaOH溶液的pH变化情况(溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高一下学期入学考试理综化学试卷(解析版) 题型:选择题
一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6 L的气体。该合金中铝、铁的物质的量之比为( )
A. 1∶1 B. 2∶5 C. 3∶2 D. 3∶5
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏学益校区高一下学期第一次(3月)月考化学试卷(解析版) 题型:填空题
现有下列物质:
①Cl2 ②Na2O2 ③NaOH ④HCl
⑤H2O2 ⑥Na2O ⑦NH4Cl ⑧CO2
(1)只由离子键构成的物质是________________(填序号,下同)
(2)只由极性键构成的物质是______
(3)只由非极性键构成的物质_______________
(4)由极性键和非极性键构成的物质是_____________
(5)由离子键和极性键构成的物质是___________
(6)由离子键和非极性键构成的物质是______________
(7)属于离子化合物的是___________________
(8)属于共价化合物的是__________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏学益校区高一下学期第一次(3月)月考化学试卷(解析版) 题型:选择题
国际无机化学命名委员会作出决定:把长式周期表原有的主、副族及族号取消,由左至右按原顺序改为18列,如碱金属为第一列,稀有气体为18列,按这个规定,下列说法中错误的是 ( )
A. 第3列元素种类最多,第14列元素形成的化合物种类最多
B. 第8、9、10三列元素中没有非金属元素
C. 只有第2列元素的原子最外层有2个电子
D. 从上到下第1列碱金属元素的单质熔点逐渐降低,第17列元素的单质熔点逐渐升高
查看答案和解析>>
科目:高中化学 来源:河北省石家庄市2016-2017学年高一下学期学情反馈(一)(解析版) 题型:选择题
1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2 ︰1
B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54沉淀时,加入NaOH溶液的体积是600mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com