
【题目】甲、乙是两种常见短周期元素的单质,有关物质的转化关系如图所示.下列有关说法,错误的是( ) 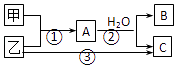
A.若C为酸性气体,则B可能具有两性
B.若C是碱性气体,则B一定是碱
C.若B,C是两种酸,则B,C一定都是一元酸
D.以上3个转变可能都是氧化还原反应
【答案】C
【解析】解:A.甲、乙是两种常见短周期元素的单质,C为酸性气体,则甲为Al,乙为S,A为Al2S3 , B为AlCl3 , C为Al(OH)3 , D为H2S,A与水的反应为Al2S3+6H2O═2Al(OH)3↓+3H2S↑,B具有两性,故A正确;
B.C为碱性气体,则甲为Mg,乙为N2 , A为Mg3N2 , B为MgCl2 , C为Mg(OH)2 , D为NH3 , A与水的反应为Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑,B一定是碱,故B正确;
C.若B、C是两种酸,A可以为SiCl4、和水反应生成H2SiO3和HCl,ICl+H2O=HIO+HCl,生成的酸可以是一元酸,也可以是二元酸,故C错误;
D.若甲乙为Na和O2 , A为Na2O2 , B为O2 , C为NaOH,乙为Na,三个反应都是氧化还原反应,故D正确;
故选C.


科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( ) 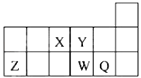
A.元素X与元素Z的最高正化合价之和的数值等于8
B.原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C.离子Y2﹣和Z3+的核外电子数和电子层数都不相同
D.元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气在工业上有着重要的用途,某兴趣小组在实验室中模拟工业上用氯气制备无水氯化铝(无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾).可用下列装置制备. 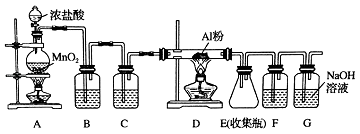
(1)装置B中盛放溶液,其作用是 . F中的是溶液,其作用是 . 用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 . 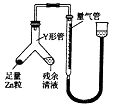
(2)装置A实验开始时,先检查装置气密性,接下来的操作依次是(填序号).
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
(3)制备反应会因盐酸浓度下降而停止.为测定反应残余液中盐酸的浓度,探究小组同学提出很多实验方案,其中方案之一为让残留的液体与足量Zn反应,测量生成的H2体积.装置如右图所示(夹持器具已略去).
①使Y形管中的残余清液与锌粒反应的正确操作是将转移到中.
②反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至不变.气体体积逐次减小的原因是(排除仪器和实验操作的影响因素).
(4)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为﹣59℃,液体为红色;Cl2沸点为﹣34℃,液态为黄绿色.设计最简单的实验验证Cl2中含有ClO2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以1,3﹣丁二烯,丙烯,乙炔等为原料合成 ![]() 流程图如图
流程图如图 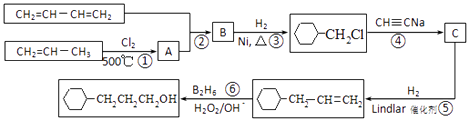
(1)反应①的反应类型是 , B中含有的官能团的名称 .
(2)写出反应②的化学方程式 .
(3)写出C的结构简式 .
(4)写出 ![]() 含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式 .
含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式 .
(5)根据以上合成信息,以乙烯为原料合成1,6﹣己二醇,其他试剂任选,写出合成的流程图 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金用途广泛,如新型储氢合金材料的研究和开发,将为氢气作为能源的实际应用起到重要的推动作用.下列材料中,不属于合金的是( )
A.青铜
B.黄铜
C.陶瓷
D.不锈钢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种元素,A元素形成的﹣2价阴离子比氦原子的核外电子数多8个,B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4g C与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子.
(1)C在周期表中的位置 .
(2)D的气态氢化物与H2S、HF的稳定性由强到弱为(用化学式表示).
(3)写出淡黄色固体E的电子式 , 其中含有的化学键为 .
(4)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),K2A2、KA2在医院、矿井、潜水、高空飞行中常用作供氧剂,为了维持气压稳定可以使用过氧化钾和超氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它们的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅酸盐的叙述中,正确的是 ( )
①硅酸盐大多都难溶于水 ②硅酸盐是构成地壳岩石的最主要成分
③硅酸盐中最常见的是Na2SiO3,它的水溶液俗称水玻璃
A. ③ B. ②③ C. ①② D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法,正确的是( )
A. 硝酸应该保存在无色的试剂瓶中
B. 新制的氯水通常保存在无色试剂瓶中
C. 氢氧化钠溶液保存在有玻璃塞的玻璃试剂瓶中
D. 氢氟酸保存在塑料瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
Ⅰ.工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。提纯硝酸锶的实验步骤如下:
①取含杂质的硝酸锶样品,向其中加入浓HNO3溶解,搅拌。
②过滤,并用浓HNO3洗涤滤渣。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH至7~8,过滤。
④将滤液用硝酸调节pH至2~3,蒸发浓缩,冷却结晶,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
(1)步骤②用浓HNO3洗涤滤渣的目的是。
(2)步骤③中肼(N2H4)将过量铬酸(CrO3)还原为Cr3+ , 同时产生一种无色无味的气体,写出该反应的离子方程式。
(3)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等,除去100L锅炉水(含氧气8g/L)的溶解氧,需要肼的质量为 。
(4)Ⅱ.Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数(写出计算过程)(精确到0.01)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com