
| 实验 | 操作 | 现象 | |
| 实验I(取褪色后溶液3等份) | 第1份 | 滴加FeCl3溶液 | 无明显变化 |
| 第2份 | 滴加KSCN溶液 | 溶液出现红色 | |
| 第3份 | 滴加稀盐酸和BaCl2 | 产生白色沉淀 | |
| 实验Ⅱ(取褪色后溶液同浓度的FeCi3溶液) | 滴加2KSCN溶液,溶液变红,再通入O2 | 无明显变化 | |
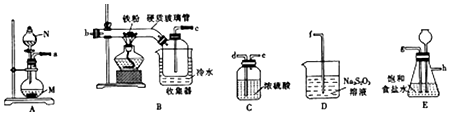
分析 生产无水氯化铁流程:A装置:制取氯气,实验室常用浓盐酸与KMnO4(或KClO3)制取,制得的氯气中混有氯化氢和水蒸气,装置E:吸收HCl,装置C:作用是干燥氯气,常用浓硫酸,装置B:铁和氯气反应2Fe+3Cl2$\frac{\underline{\;加热\;}}{\;}$2FeCl3,冰水浴冷凝氯化铁并收集,氯气不能直接排放,用硫代硫酸钠在D装置中尾气吸收,S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,据此分析(1)~(4);
(5)将硬质玻璃管及收集器中的物质转移至锥形瓶中,加入过量的稀盐酸,得到淡黄色溶液,加入KSCN溶液,溶液淡红色,说明有铁离子,加入过量的过氧化氢溶液,溶液变深红色,说明铁离子浓度变大,即溶液中有亚铁离子,静置一段时间,红色退去;
对褪色溶液研究,实验I说明溶液中铁离子没有变化,有硫酸根离子生成,实验Ⅱ另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化,说明O2不能氧化SCN-,则该硫酸根离子由H2O2将SCN-氧化成SO42-.
解答 解:(1)根据仪器构造可知仪器N为分液漏斗;A装置用来制备氯气,从装置可知为固液不加热型制备氯气,选用浓盐酸与KMnO4(或KClO3)制取,
故答案为:分液漏斗;KMnO4(或KClO3);
(2)A装置制取氯气,制得的氯气中混有氯化氢和水蒸气,用饱和食盐水吸收氯化氢气体,所以a连接g连接h,在C装置中用浓硫酸吸收水蒸气,为吸收充分,导气管长进短出,则h连接d连接e,干燥纯净的氯气在B中与铁反应,则e连接b连接c,氯气不能直接排放,用硫代硫酸钠在D装置中尾气吸收,为防止D装置中的水蒸气进入氯化铁的收集装置,故尾气处理之前再接一个干燥装置;
故答案为:a,g,h,d,e,b,c;
(3)若缺少装置E,氯气中混有HCl,HCl和Fe反应生成的H2与Cl2混合受热发生爆炸,且有杂质氯化亚铁生成;
故答案为:HCl和Fe反应生成的H2与Cl2混合受热发生爆炸,且有杂质氯化亚铁生成;
(4)装置D中,硫代硫酸钠(Na2S2O3)与氯气反应,Na2S2O3被氧化为Na2SO4,氯气被还原为氯离子,离子方程式为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
故答案为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
(5)①加入KSCN溶液,溶液淡红色,说明有铁离子,加入过量的过氧化氢溶液,溶液变深红色,说明铁离子浓度变大,即溶液中有亚铁离子,过氧化氢将亚铁离子氧化为铁离子使铁离子浓度增大,离子方程式为:2Fe2++2H++H2O2=2F3++2H2O;
故答案为:2Fe2++2H++H2O2=2F3++2H2O;
②红色褪去的同时有气体生成,经检验气体为O2,说明有氧化还原反应的发生,实验I说明溶液中铁离子没有变化,有硫酸根离子生成,实验Ⅱ另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化,说明O2不能氧化SCN-,则该硫酸根离子由H2O2将SCN-氧化成SO42-;
故答案为:H2O2将SCN-氧化成SO42-.
点评 本题通过探究氯气与铁反应,考查了物质性质实验方案的设计方法,题目难度中等,注意掌握氯气与铁反应的现象、反应原理,明确物质性质实验方案的设计原则,试题充分考查了学生的分析、理解能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯中加溴水振荡,溴水层褪色 | |
| B. | 乙烯通入溴水,溴水褪色 | |
| C. | 石油裂解后的气体通入溴水,溴水褪色 | |
| D. | 苯转化为环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | KNO3的溶解度大 | 用重结晶法除去KNO3中混有的NaCl |
| B | 收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,气体颜色变浅 | 生成的红棕色NO2气体部分转化为无色气体 |
| C | 用pH试纸测定NaClO溶液的酸碱性,试纸显蓝色 | NaClO水解显碱性 |
| D | Ca(OH)2能制成澄清石灰水 | 可配制2.0mol•L-1的Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
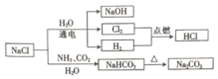
| A. | NaHCO3的热稳定性较好 | |
| B. | H2与Cl2反应时产生苍白色火焰 | |
| C. | NaOH俗称纯碱 | |
| D. | 图中所示转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止食品的氧化变质,常在食品包装袋中放入生石灰 | |
| B. | 节日里绚丽的烟花,是通过某些金属元素的化学变化实现的 | |
| C. | SO2具有漂白性,通常用于银耳等食品的漂白 | |
| D. | 干冰或碘化银可用于进行人工降雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸因具有吸水性,所以能使蔗糖炭化 | |
| B. | 实验室用浓硫酸与亚硫酸钠反应制SO2,体现浓硫酸的强氧化性 | |
| C. | 常温下,铁遇浓硫酸发生钝化,铁表面生成致密的氧化膜 | |
| D. | 浓硫酸作干燥剂,可以干燥H2、CO2、NH3、Cl2等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向含有氯化铁杂质的氯化铜溶液中加入铜 | 除去氯化铁杂质 |
| B | 向某溶液中加入盐酸话的氯化钡溶液 | 效验SO${\;}_{4}^{2-}$的存在 |
| C | 常温下,用pH计测定NaHCO3溶液的pH | 比较HCO${\;}_{3}^{-}$水解、电离程度的相对大小 |
| D | 将SO2通入Ba(NO3)2溶液中 | 证明BaSO3不溶于水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ρ=$\frac{(36.5V+22400)c}{V}$ | B. | c=$\frac{1000Vρ}{36.5V+22400}$ | ||
| C. | V=$\frac{22400ω}{36.5(1-ω)}$ | D. | ρ=$\frac{36.5c}{1000ω}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com