
【题目】在SO3+H2O=H2SO4反应中,反应前后发生改变的是( )
A.分子总数B.元素种类C.各元素化合价D.原子种类
科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中,发生反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡状态时缩小容器容积,下列叙述不正确的是
2SO3(g),达到平衡状态时缩小容器容积,下列叙述不正确的是
A. 该反应的平衡常数不变 B. 平衡向正反应方向移动
C. SO3的浓度增大 D. 正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是
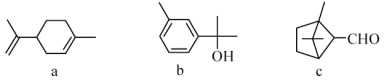
A. a和b都属于芳香族化合物
B. b的一氯代物有5种
C. a、b和c均能和氢气在一定条件下发生加成反应
D. a和c分子中所有碳原子均处于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨能和NaH反应放出H2:NaH + NH3 =NaNH2 + H2↑,它也能和Na反应放出H2。据此下列说法中错误的是( )
A. 液氨和NaH反应中,液氨是氧化剂
B. 液氨和NaH反应生成的H2既是氧化产物又是还原产物
C. 液氨和Na反应产物中有NaNH2
D. 液氨和NaH或Na反应都属于置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与装置均正确的是( )

A. 用甲装置从青蒿中提取对治疗疟疾有特效的青蒿素
B. 用乙装置配制酸碱中和滴定的标准液(0.1000mol/L HCl)
C. 用丙装置从海带灰中提取碘单质
D. 用丁装置将含等物质的量的K2SO4和Al2(SO4)3的混合溶液蒸干得到明矾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳族元素包括碳、硅、锗(Ge)、锡(Sn)、铅等,它们的单质及化合物广泛应用于我们生活的各个领域。锗和锡以前曾被用于半导体材料,铅被用来制造蓄电池。碳族元素在化合物中只有铅以低价形式存在时较稳定,其它元素在化合物中都是以高价形式存在比较稳定,回答下列问题:
I.(1)高岭土的成分中含Al2(Si2O5)(OH)4,请改写成氧化物的形式_________________.
(2)实验室用单质锡粉制取少量二氯化锡溶液,制取和保存的方法是(用文字叙述)_______________________________
(3)铅有多种氧化物,写出四氧化三铅与浓盐酸反应的离子方程式_____________________ .二氧化铅在空气中强热会得到一系列铅的其它氧化物。若把239g二氧化铅强热,当质量变为231g时,写出反应的化学方程式____________________________.
II.CH4–CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
CH4–CO2催化重整反应为:CH4(g)+ CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
已知:C(s)+2H2(g)= CH4 (g) ΔH=–75 kJ·mol1 ①
C(s)+O2(g)=CO2(g) ΔH=–394 kJ·mol1 ②
2C(s)+O2 (g)=2CO(g) ΔH=–222kJ·mol1 ③
(1)有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)若该反应在容积不变的绝热容器中进行,能够判断该反应已达到平衡的是____(填标号)。
A.c(CO2)/c(H2)不再发生变化
B.气体的密度不再发生变化
C.气体的平均摩尔质量不再发生变化
D.每有8molC-H键生成的同时有4molH-H键的断裂 E.容器的温度不再发生变化
(3)T℃时,在体积为10 L的容器中加入10 mol CH4、5 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,此温度下,该反应的化学平衡常数K=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去),请回答下列问题:
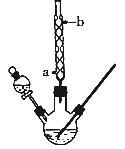
(1)球形冷凝管的作用是____________,冷凝水从____________(填“a”或“b”)处进入。
(2)已知下列数据:
乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
溶点/℃ | 117.3 | 16.6 | -83.6 | |
沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
又知温度高于140℃时发生副反应:2CH3CH2OH→CH3CH2OCH2CH3+H2O
①该副反应属于____________反应(填字母)。
a.加成反应 b.取代反应 c.酯化反应 d.消去反应
②考虑到反应速率等多种因素.用上述装置制备乙酸乙酯时,反应的最佳温度范围是____________(填字母)。
a.T<77.5℃ b.T>150℃ c.115℃<T<130℃
(3)反应结束后,欲从反应混合物中分离出乙酸乙酯,应使用的分离方法是____________(填操作方法名称,下同),所用到的主要仪器为____________,进行此步操作后,所得有机层中的主要无机物杂质是水,在不允许使用干燥剂的条件下,除去水可用____________的方法:在乙酸乙酯的同类物质的同分异构体中,有一种直链的酯在强碱条件下与新制氢氧化铜浊液混合加热一段时间后,发现生成了砖红色沉淀,请写出的化学方程式________________________。
(4)若实验所用乙酸质量为6.0g,乙醇质量为5.0g,得到纯净的产品质量为4.4g.则乙酸乙酯的产率是____________。
(5)乙二酸和乙二醇也能发生酯化反应,写出生成环酯的化学反应方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究晶体的结构对化学新材料的发现有着重要的价值。
(1)晶胞中任一个原子的中心位置均可用称之为原子分数坐标的三个分别小于1的数(x,y,z)来予以规定。某晶体的晶胞结构如图所示,1号原子坐标为(0,0,0),2号原子坐标为(1/3,2/3,0),该晶体的化学式为___________,该晶胞参数为:a = 250.4 pm, c = 666.1 pm,γ = 120o; 3号原子坐标为_____________,列出上述晶体中A和B两原子间的最小核间距的计算式为_____________。(不必算出数值,但需要化简)

(2)体心立方堆积的晶胞是个立方体,如果半径为r的原子保持紧密接触,立方体的中心能容得下半径最大为___________的一个原子。
(3)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71 g·cm-3,晶胞边长为4.28×10-10 m,则FexO中x=__________(结果保留两位有效数字)。
(4)钙钛矿晶体的结构如图所示。假设把氧离子看做硬球接触模型,钙离子和钛离子填充氧离子的空隙,氧离子形成正八面体,钛离子位于正八面体中心,则一个钛离子被__________个氧离子包围;钙离子位于立方晶胞的体心,一个钙离子被_____个氧离子包围。钙钛矿晶体的化学式为__________。若氧离子半径为a pm,则钙钛矿晶体中两个钛离子间最短距离为_______pm,钛离子与钙离子间最短距离为_______pm。

(5)钛元素有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示F晶体的结构中,晶胞参数a=0.295nm,c=0.469nm,则该F晶体的密度为_____________ g· cm-3
(用NA表示阿伏加德罗常数的值,列出计算式即可,不用化简)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com