

| A. | ①中阳极处能产生使湿润淀粉KI试纸变蓝的气体 | |
| B. | ②中待镀铁制品应与电源正极相连 | |
| C. | ③中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法 | |
| D. | ④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
分析 A、①装置是电解池,阳极上是活性电极;
B、②装置待镀制品和电源负极相连做电解池的阴极;
C、③装置是电解池,在电解池中,阴极被保护;
D、④装置离子交换膜允许离子通过,氯气不能通过.
解答 解:A、①装置是电解池,铁做阳极,由于阳极上是活性电极,故氯离子不放电,即阳极不能生成氯气,故A错误;
B、②装置中待镀制品上要有Cu2+放电析出铜,故应和电源负极相连做电解池的阴极,故B错误;
C、③装置是电解池,在电解池中,阴极被保护,故钢闸门应与外接电源的负极相连,故C错误;
D、氯气是酸性气体,能和氢氧化钠反应.而氯气在阳极生成,NaOH在阴极生成,而④装置中的离子交换膜允许离子通过,氯气不能通过,可以避免生成的Cl2与NaOH溶液反应,故D正确;
故选D.
点评 本题考查了电解池、原电池工作原理的应用,电极名称、电极判断、电极反应、电子流向、电解应用等基础知识,熟练掌握基础是解题关键.


科目:高中化学 来源: 题型:解答题
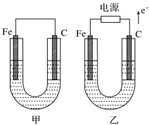 如图所示,甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题.
如图所示,甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是同学们经常使用的某品牌修正液包装标签.小明仔细阅读后,结合自己的生活经验和所学知识得出了修正液的某些性质,小明的推测中不合理的是( )
如图是同学们经常使用的某品牌修正液包装标签.小明仔细阅读后,结合自己的生活经验和所学知识得出了修正液的某些性质,小明的推测中不合理的是( )| A. | 修正液是一种胶体,均一、稳定 | B. | 修正液中含有有毒的化学物质 | ||
| C. | 修正液的成分对纸张不具腐蚀性 | D. | 修正液的溶剂易挥发、易燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
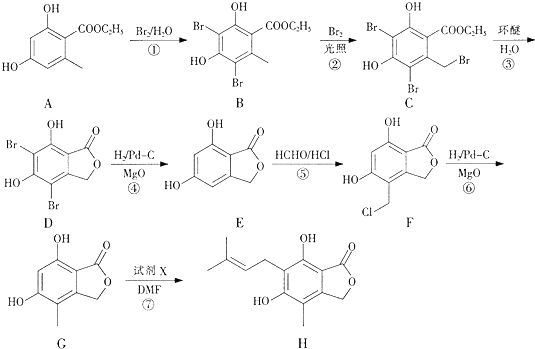
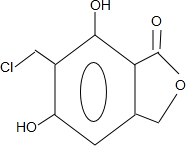 (任写一种).
(任写一种).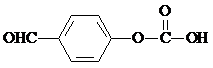 或
或 .
.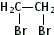
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol Cl2 | |
| B. | 标准状况下3.36 L CO | |
| C. | 5.6g N2 (N2的摩尔质量为28 g•mol-1) | |
| D. | 含NA个分子的O2(NA为阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
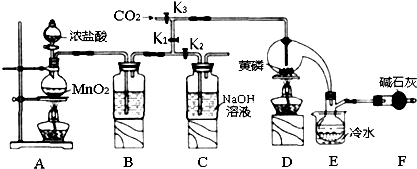
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com