
| A. | CO2 | B. | NH3 | C. | Cl2 | D. | SO2 |
分析 根据n=$\frac{m}{M}$可知,相同质量的气体,其物质的量与摩尔质量成反比,同温同压下,气体体积之比等于其物质的量之比,故相同质量的气体,其体积与摩尔质量成反比,摩尔质量越大,占有的体积越小.
解答 解:CO2的摩尔质量为44g/mol,NH3的摩尔质量为17g/mol,Cl2的摩尔质量为71g/mol,SO2的摩尔质量为64g/mol,根据n=$\frac{m}{M}$可知,相同质量的气体中氨气物质的量最大,同温同压下,气体体积之比等于其物质的量之比,故同温同压下,相同质量的气体,NH3的体积最大,故选B.
点评 本题考查物质的量的有关计算、阿伏伽德罗定律及推论等,比较基础,注意基础知识理解掌握.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题

| A. | Z结构中有4个手性碳原子 | |
| B. | Y的分子式为C9H8O3 | |
| C. | 1molZ余足量NaOH溶液反应,最多消耗8molNaOH | |
| D. | 1molZ与浓溴水反应最多消耗3molBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 | |
| B. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 | |
| C. | 常温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 | |
| D. | 0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列叙述正确的是( )
,下列叙述正确的是( )| A. | 有机物A属于芳香烃 | |
| B. | 有机物A和浓硫酸混合加热,可以发生消去反应 | |
| C. | 有机物A中含有两种官能团 | |
| D. | l mol A和足量的NaOH溶液反应,最多可以消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医用酒精是用淀粉类植物发酵经蒸馏制成,浓度通常是75% | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果,其作用是吸收并氧化水果释放出的乙烯 | |
| C. | “海水淡化”可以解决“淡水供应危机”,向海水中加入明矾可以使海水淡化 | |
| D. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,则合成它的单体是( )
,则合成它的单体是( )| A. | 氟乙烯和全氟丙烯 | B. | 1,1-二氟乙烯和全氟丙烯 | ||
| C. | 全氟异戊二烯 | D. | 1-三氟甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
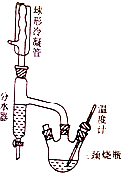 实验室制备正丁醚的原理如下:
实验室制备正丁醚的原理如下:| 物质 | 密度/g•mL-1 | 熔点/℃ | 沸点/℃ | 水溶性 |
| 正丁醇 | 0.81 | -89.8 | 117.7 | 微溶于水 |
| 正丁醚 | 0.769 | -98 | 142 | 不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com