
下列说法正确的是( )
A.热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的
B.升高温度或加入催化剂,可以改变化学反应的反应热
C.据能量守恒定律,反应物的总能量一定等于生成物的总能量
D.物质发生化学变化一定伴随着能量变化
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
为验证碳酸氢钠固体中是否含有碳酸钠,下列实验操作及判断正确的是( )
A.观察加热时能否放出气体
B.观察滴加盐酸时能否放出气体
C.溶于水中,滴加澄清石灰水,观察是否有沉淀生成
D.溶于水中,滴加少量氯化钡溶液,观察是否有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,辛烷的燃烧热为5 518 kJ·mol-1。下列热化学方程式书写正确的是( )
A.2H+(aq)+SO(aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ·mol-1
B.KOH(aq)+1/2H2SO4(aq)===1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
C.C8H18(l)+25/2O2(g)===8CO2(g)+9H2O(g) ΔH=-5 518 kJ·mol-1
D.2C8H18(g)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-5 518 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为:2FeCl3+Cu===2FeCl2+CuCl2,向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉。反应结束后,下列结果不可能出现的是( )
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁铜都有 D.烧杯中铁铜都无
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙三种物质之间有如下转化关系:
甲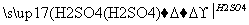 乙
乙 丙
丙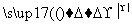 甲
甲
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是________。写出“乙 丙”转化的离子方程式:________________________________________________。
丙”转化的离子方程式:________________________________________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲物质是:________。写出“甲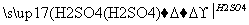 乙”转化的离子反应方程式:________________________________________________。
乙”转化的离子反应方程式:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O2(g)2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.已知H+(aq)+OH-(aq)===H2O(l)
ΔH=-57.3 kJ·mol-1,则任何酸碱中和反应的热效应均为57.3 kJ
D.已知2C(s)+2O2(g)===2CO2(g) ΔH1,2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
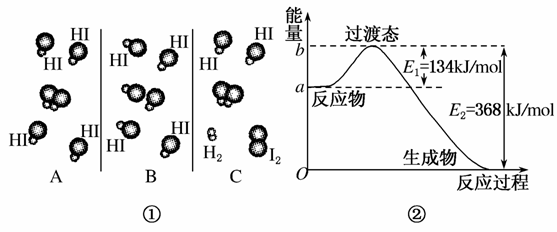
(1)图①是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是________(选填“A”、“B”或“C”)。
(2)20世纪30年代Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图②是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:________________________________________________________
______________________________________________________________。
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。请在图②中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图。
(4)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单地理解为断开1 mol化学键所需吸收的能量,下表是部分化学键的键能数据:
| 化学键 | P—P | P—O | O===O | P===O |
| 键能/kJ·mol-1 | 197 | 360 | 499 | x |
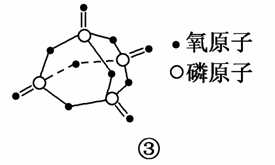
已知白磷的燃烧热为2 378.0 kJ/mol,白磷完全燃烧的产物结构如图③所示,则上表中x=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
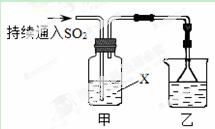 某化学兴趣小组用以下装置探究SO2的某些化学性质。
某化学兴趣小组用以下装置探究SO2的某些化学性质。
(1)装置乙的作用是 。
(2)若X为品红溶液,观察到溶液褪色,说明SO2具有 (填序号,下同);若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 。
a.氧化性 b.还原性 c.漂白性
(3)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式:
 Ca2++
Ca2++ ClO-+
ClO-+ SO2+
SO2+ H2O=
H2O= ↓+
↓+ Cl-+
Cl-+ SO42-+
SO42-+ 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2SO2(g)+O2(g) 2SO3(g) ΔH=-197 kJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)
2SO3(g) ΔH=-197 kJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)
1 mol SO2和0.5 mol O2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.容器内压强p:p甲=p丙>2p乙
B.SO3的质量m:m甲=m丙>2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙>k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com