
【题目】图为氢氧燃料电池原理示意图,按照此图的提示,回答以下问题: 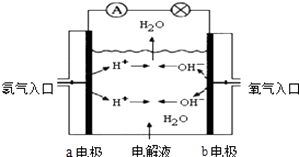
(1)下列叙述不正确的是 A a电极是负极
B b电极的电极反应为:4OH﹣﹣4e﹣=2H2O+O2↑
C 氢氧燃料电池是一种具有应用前景的绿色电源
D 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)若电解质溶液为KOH溶液,则电极反应式为:a极b极
(3)若电解质溶液为稀H2SO4 , 则电极反应式为:a极b极
【答案】
(1)B
(2)2H2﹣4e﹣+4OH﹣=4H2O;O2+2H2O+4e﹣=4OH﹣
(3)2H2﹣4e﹣=4H+;O2+4H++4e﹣=2H2O
【解析】解:(1)A、氢氧燃料电池中,氢气易失电子发生氧化反应,所以通入氢气的a极为电源的负极,故A正确; B、氢氧燃料电池中,通入氧气的b极为原电池的正极,正极上氧气得电子发生还原反应,要根据电解质溶液的酸碱性确定其电极反应式,故B错误;
C、氢氧燃料电池的产物是水,环保无污染,是一种具有应用前景的绿色电源,故C正确;
D、氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏电池内的新型发电装置,故D正确.
故选B;(2)当电解质是碱时,氢气失电子生成的氢离子在碱性溶液中不能稳定存在,它和氢氧根离子反应生成水,所以负极上发生的电极反应是氢气失电子和氢氧根离子生成水,即电极反应式为2H2﹣4e﹣+4OH﹣=4H2O;正极上氧气得电子和水生成氢氧根离子,所以其电极反应式为 O2+2H2O+4e﹣=4OH﹣ ,
所以答案是:2H2﹣4e﹣+4OH﹣=4H2O;O2+2H2O+4e﹣=4OH﹣;(3)负极上失电子发生氧化反应,电解质是酸,所以负极上氢气失电子后生成的微粒是氢离子,故其电极反应式为:2H2﹣4e﹣=4H+;正极上氧气得电子和氢离子反应生成水,发生还原反应,故其电极反应式为:O2+4H++4e﹣=2H2O,
所以答案是:2H2﹣4e﹣=4H+;O2+4H++4 e﹣=2H2O.


科目:高中化学 来源: 题型:
【题目】根据题意填空
(I)甲烷在一定条件下可生成以下微粒:
A.碳正离子(CH3+ ) B.碳负离子(CH3﹣) C.甲基 (﹣CH3) D.碳烯(:CH2)
①四种微粒中,键角为120°的是(填序号).
②碳负离子(CH3﹣)的空间构型为 , 与CH3﹣互为等电子体的一种分子是(填化学式).
(II )在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学方程式为(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac.请回答下列问题:
①C、N、O的电负性由大到小的顺序为 .
②写出Cu的核外电子排布式 .
③化合物Cu(NH3)3(CO)Ac中,金属元素的化合价为 .
④在一定条件下NH3和CO2能合成尿素CO(NH2)2 , 尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为 .
⑤Cu2O晶体的晶胞结构如图所示,若阿伏伽德罗常数为NA , 晶胞的边长为apm,则晶体的密度为gcm﹣3 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色未知溶液中检验出有Ba2+、Ag+ , 同时又测得其酸性很强.某学生还要鉴定此溶液中是否大量存在①Cu2+ ②Fe3+ ③Cl﹣ ④NO ![]() ⑤S2﹣ ⑥CO
⑤S2﹣ ⑥CO ![]() ⑦NH
⑦NH ![]() ⑧Mg2+ ⑨Al3+ , 而事实上有部分离子不用鉴定就能加以否定,你认为不必鉴定的是( )
⑧Mg2+ ⑨Al3+ , 而事实上有部分离子不用鉴定就能加以否定,你认为不必鉴定的是( )
A.③⑤⑥⑦⑨
B.①②⑤⑥⑧
C.③④⑦⑧⑨
D.①②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( ) ①将金属Na投入水中:2Na+2H2O=2Na++2OH﹣+H2↑
②在硫酸溶液中加入氢氧化钡溶液至中性:Ba2++OH﹣+H++SO ![]() =BaSO4↓+H2O
=BaSO4↓+H2O
③碳酸氢钙溶液中滴加盐酸:HCO ![]() +H+=CO2↑+H2O
+H+=CO2↑+H2O
④碳酸钙中滴加盐酸:CO ![]() +2H+=CO2↑+H2O.
+2H+=CO2↑+H2O.
A.①③④
B.①③
C.②④
D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有足量M的体积可变的密闭容器中加入N,发生反应:M (s)+2N (g)═4P (s)+Q(g)△H<0.在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的转化关系如图所示.下列说法正确的是( )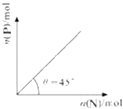
A.平衡时N的转化率为50%
B.当温度升高后,则图中θ>45°
C.若再加入N,则正、逆反应速率均逐渐增大
D.若在加入N,则反应体系中气体密度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下图所示A~F六种仪器,请根据要求填空.
(1)下列实验操作中用到仪器F的是(选填下列选项的编号字母).a.分离水和CCl4的混合物
b.分离水和酒精的混合物
c.分离水和泥沙的混合物
(2)实验室用浓盐酸配制100mL0.5molL﹣1的稀盐酸.①上述仪器中一定不会用到的是(填写仪器的编号字母)
②下列关于仪器E的使用方法中正确的是(填下列选项的编号字母).
a、使用前应检查是否漏液. b.使用前必须烘干
c.不能用作物质反应或溶解的容器 d、热溶液可直接转移到容量瓶中
③下列操作会使所配溶液浓度偏高的是(填下列选项的编号字母).
a、没有将洗涤液转移到容量瓶 b.转移过程中有少量溶液溅出
c.定容后摇匀,液面下降,继续加水至刻度线 d.定容时俯视刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g)在温度T0下的2L密闭容器中,加入0.30mol SiCl4 , 0.20mol N2.0.36mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80g
Si3N4(s)+12HCl(g)在温度T0下的2L密闭容器中,加入0.30mol SiCl4 , 0.20mol N2.0.36mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80g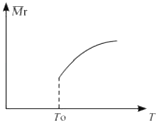
(1)SiCl4的平均反应速率为
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的关系如图所示,下列说法正确的是( )
A.该反应在任何温度下可自发进行
B.若混合气体的总质量不变,表明上述反应己达到平衡状态
C.其他条件不变,增大Si3N4的物质的量,平衡向左移动
D.按3:2:6的物质的量比增加反应物,SiCl4(g)的转化率降低
(3)下表为不同温度下该反应的平衡常数,其他条件相同时,在(填“T1”、“T2”、“T3”)温度下反应达到平衡所需时间最长:
温度T | T1 | T2 | T3 |
平衡常数K | 1.2 | 2.5 | 10 |
假设温度为T1时向该反应容器中同时加入.c(SiCl4)=0.3mol/L,c(H2)=0.3mol/L,c(N2)=x mol/L,c(HCl)=0.3mol/L和足量Si3N4 (s),若要使平衡建立的过程中HCl浓度减小,x的取值范围为
(4)该反应的原子利用率为
(5)工业上制备SiCl4的反应过程如下:
①SiO2(s)+2C(s)═Si(s)+2CO(g),△H═akJ/mol
②Si(s)+2Cl2(g)═SiCl4(l),△H=bkJ/mol
③SiCl4(g)═SiCl4(l),△H═ckJ/mol
写出二氧化硅、焦炭与Cl 2在高温下反应生成气态SiCl4和一氧化碳的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,近来发现了一种新的星际分子氰基辛炔,其结构简式为HC≡C—C≡C—C≡C—C≡C—C≡N。下列对该物质的判断正确的是( )
A.属于不饱和烃
B.不能使酸性KMnO4溶液褪色
C.所有原子都在同一条直线上
D.可由乙炔和含氮化合物加聚制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以熔融LiCO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图,下列说法正确的是( )
A.以此电池为电源精炼铜,当有0.1mole﹣转移时,有3.2g铜溶解
B.若以甲烷为燃料气时负极反应式:CH4+5O2﹣﹣8e﹣=CO32﹣+2H2O
C.该电池使用过程中需补充Li2CO3和K2CO3
D.空气极发生电极反应式为:O 2+4e﹣+2CO2=2CO32﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com