
| A、该溶液中氯化镁的物质的量浓度为1mol/L |
| B、CI--的物质的量浓度为2mol/L |
| C、含溶质氯化镁的质量为47.5g |
| D、取出0.25 L倒入烧杯中CI--的浓度为1mol/L |
| n |
| V |
| 1mol |
| 0.5L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150 mL 1 mol?L-1的KClO3 |
| B、75 mL 1.5 mol?L-1的NH4Cl |
| C、75 mL 2 mol?L-1的CaCl2 |
| D、150 mL 3 mol?L-1的KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沾附在试管内壁上的油脂,用热碱液洗涤 |
| B、蒸馏操作时应将温度计的水银球插入液面下 |
| C、苯酚有毒,若其浓溶液不慎沾到皮肤上,应立即用NaOH溶液冲洗 |
| D、向蔗糖溶液中加入几滴稀硫酸,水浴加热,再向其中加入银氨溶液,可产生银镜 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
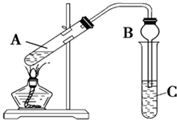 某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL冰醋酸混合,分别进行制取乙酸乙酯的研究.
某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL冰醋酸混合,分别进行制取乙酸乙酯的研究.| 组序号 | 催化剂 | 反应现象 | C中饱和碳酸钠溶液中酯层高度 |
| ① | 2mL 98%浓硫酸 | 20秒时溶液出现棕色,随反应进行,溶液颜色逐步加深,最后成黑色;酯层无气泡 | 2.10cm |
| ② | 2mL14mol?L-1 硫酸 | 反应后溶液呈浅棕色;酯层与饱和碳酸钠溶液界面清晰,没有气泡 | 2.14cm |
| ③ | 2mL10mol?L-1 硫酸 | 反应后溶液呈无色;酯层与饱和碳酸钠溶液界面清晰,没有气泡 | 2.16cm |
| ④ | 2mL7mol?L-1 硫酸 | 反应后溶液呈无色;酯层与饱和碳酸钠界面有气泡 | 2.00cm |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com