
A、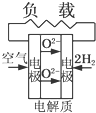 固体氧化物燃料电池 |
B、 碱性氢氧燃料电池 |
C、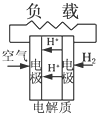 质子交换膜燃料电池 |
D、 熔融盐燃料电池 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 12a |
| b |
| m |
| (aNA) |
| A、①③ | B、②④ | C、①② | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q1+Q2<Q3 |
| B、Q1+Q2>2Q3 |
| C、2Q1+Q2>2Q3 |
| D、2Q1+Q2<2Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
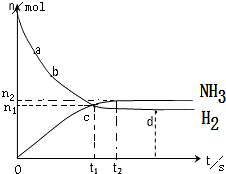 合成氨工业对国民经济和社会发展具有重要的意义.一定温度下,在2L的密闭容器中加入一定量的N2和H2,发生合成氨反应,其中n(NH3)和n(H2)随时间变化的关系如图所示.
合成氨工业对国民经济和社会发展具有重要的意义.一定温度下,在2L的密闭容器中加入一定量的N2和H2,发生合成氨反应,其中n(NH3)和n(H2)随时间变化的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
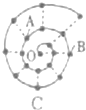 某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表-种元素,其中0点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表-种元素,其中0点代表氢元素.下列说法中正确的是( )| A、虚线相连的元素处于同一族 |
| B、离0点越远的元素原子半径越大 |
| C、.B、C最高价氧化物的水化物可相互反应 |
| D、A、B组成的化合物中不可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标况下,22.4L苯的分子数为NA |
| B、10.0mL 18mol/L的浓硫酸中氢离子数为0.36NA |
| C、6.4gS6与S8的混合物中所含S原子数一定为0.2NA |
| D、标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的 |
| B、在盐酸中加入相同浓度的氨水,若混合液温度下降,说明盐类水解是吸热的 |
| C、在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的 |
| D、在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用AgNO3鉴别工业盐(亚硝酸钠)和食盐二种溶液 |
| B、海带中碘元素提取时氧化滤液中的I-时应加入过量氯水 |
| C、将3-4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
| D、溶质的溶解度越大,溶液的浓度越高,溶剂的蒸发速度越快,溶液的冷却速度越快,析出的晶体就越细小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com