
把稀硫酸倒在亚硫酸钠粉末上,能使反应的最初速率加快的是( )
①增大亚硫酸钠粉末的量 ②硫酸浓度增大一倍,用量减少到原来的1/2 ③硫酸浓度不变,用量增大一倍 ④使反应在较高温度进行
A.①② B.②④ C.①③ D.②③
科目:高中化学 来源: 题型:
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3 (aq)+S(s)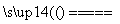 Na2S2O3 (aq)
Na2S2O3 (aq)
实验步骤:
① 称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。 另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
② 安装实验装置(如图所示,部分夹持装置略去),水浴加热, 微沸60分钟。
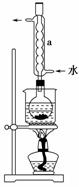
③ 趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________________________
__________________________________________。
(2)仪器a的名称是________,其作用是__________________________________________
__________________________________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无
机杂质是________。 检验是否存在该杂质的方法是__________________________________________
__________________________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因: __________________________________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂, 用0.100 0 mol·L-1碘的标准溶液滴定。 反应原理为:2S2O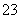 +I2===S4O
+I2===S4O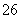 +2I-
+2I-
(5)滴定至终点时,溶液颜色的变化:________。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为______________ mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)________。 Ⅲ.Na2S2O3的应用

(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO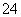 ,常用作脱氯剂,该反应的离子方程式为__________________________________________
,常用作脱氯剂,该反应的离子方程式为__________________________________________
__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
过渡金属催化的新型碳碳偶联反应是近年来有机合成的研究热点之一,如:
反应①
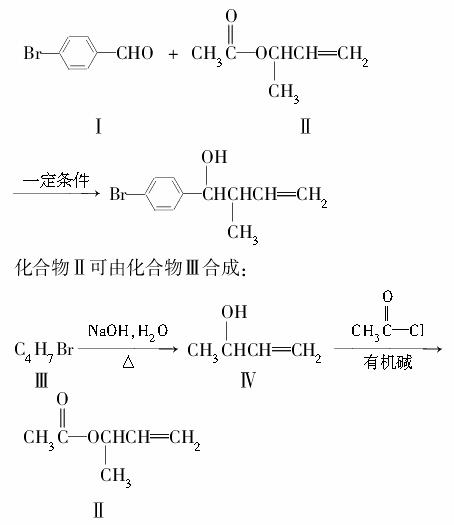
(1)化合物Ⅰ的分子式为________。
(2)化合物Ⅱ与Br2加成的产物的结构简式为________。
(3)化合物Ⅲ的结构简式为________。
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应方程式为____________________________(注明反应条件)。因此,在碱性条件下,由Ⅳ与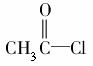 反应合成Ⅱ,其反应类型为________。
反应合成Ⅱ,其反应类型为________。
(5)Ⅳ的一种同分异构体Ⅴ能发生银镜反应。Ⅴ与Ⅱ也可发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为________(写出其中一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氯酸盐(如NaClO2)可用作漂白剂,在常温下不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2===4ClO2↑+H++Cl-+2H2O。分解时,刚加入硫酸,反应缓慢,随后突然反应释放出大量的ClO2,这是因为( )
A.酸使亚氯酸的氧化性增强
B.溶液中的H+起催化作用
C.溶液中的Cl-起催化作用
D.逸出的ClO2使反应生成物的浓度降低
查看答案和解析>>
科目:高中化学 来源: 题型:
用如下图所示装置进行下列实验。
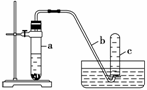
(1)在检查装置气密性后,向试管a中加入10 mL 6 mol·L-1硝酸和1 g Cu片,立即将带有导管的橡皮塞塞紧试管口。请写出在试管a中有可能发生的所有反应的化学方程式
________________________________________________________________________
________________。
(1) 实验过程中反应开始时速率缓慢,随后逐渐加快,这是由于
________________________________________________________________________,
当反应进行一段时间后速率又逐渐减慢,原因是
________________________________________________________________________
________________________________________________________________________。
(3)欲较快地制得NO,可采取的措施是( )
A.加热 B.使用铜粉 C.稀释HNO3 D.改用浓HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,向2 L密闭容器中加入2 mol N2和10 mol H2发生反应:N2+3H2
 2NH3,2 min时,测得剩余N2为1 mol,对于这个化学反应的反应速率表示不正确的是( )
2NH3,2 min时,测得剩余N2为1 mol,对于这个化学反应的反应速率表示不正确的是( )
A.v(N2)=0.25 mol·L-1·min-1
B.v(H2)=0.75 mol·L-1·min-1
C.v(NH3)=0.5 mol·L-1·min-1
D.v(N2)=0.5 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间3 h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
相应的热化学方程式如下:
N2(g)+3H2O(l)===2NH3(g)+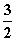 O2(g)
O2(g)
ΔH=765.2 kJ·mol-1
回答下列问题:
(1)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议:
________________________________________________________________________
________________________________________________________________________。
(3)工业合成氨的反应为N2(g)+3H2(g)
 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为 。计算:
。计算:
①该条件下N2的平衡转化率;
②该条件下反应2NH3(g)
 N2(g)+3H2(g)的平衡常数。
N2(g)+3H2(g)的平衡常数。
查看答案和解析>>
科目:高中化学 来源: 题型:
将Ca(OH)2加入蒸馏水中,一段时间后达到沉淀溶解平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq)。下列说法中正确的是( )
A.恒温下向溶液中加CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.恒温下向溶液中加CaO后,溶液中的n(OH-)减小
D.向溶液中加入少量的NaOH固体,Ca(OH)2固体的质量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com