
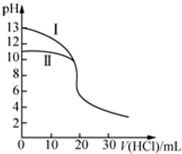
| A�� | ���ʾ���ǵζ���ˮ�����ߣ���V��HCl��=20 mLʱ��c��Cl-����c��NH4+����c��H+����c��OH-�� | |
| B�� | ��pH=7ʱ���ζ���ˮ���ĵ�V��HCl����20 mL����c��NH4+��=c��Cl-�� | |
| C�� | �ζ�����������Һʱ����V��HCl����20 mL����һ���У�c��Cl-����c��Na+����c��H+����c��OH-�� | |
| D�� | ���ζ���ˮ����V��HCl��=10 mLʱ���У�2[c��OH-��-c��H+��]=c��NH4+��-c��NH3•H2O�� |
���� δ��HClʱ����ͬŨ�ȵİ�ˮ��NaOH��Һ��pH��NaOH���ڰ�ˮ������ͼ֪��IΪ�ζ�NaOH���ߣ�IIΪ�ζ���ˮ���ߣ�
A����V��HCl��=20 mLʱ��HCl�Ͱ�ˮǡ����ȫ��Ӧ�����Ȼ�泥��Ȼ����ǿ������������Һ�����ԣ���c��H+����c��OH-�������ݵ���غ�֪��c��Cl-����c��NH4+����笠�����ˮ��̶Ƚ�С��
B��pH=7ʱ����Һ��c��H+��=c��OH-�������ݵ���غ��c��NH4+��=c��Cl-�����Ȼ����Һ�����ԣ�Ҫʹ�����Һ�����ԣ���ˮӦ����������
C���ζ�����������Һʱ����V��HCl����20 mL����Һ��c��H+����c��OH-������ϵ���غ��c��Cl-����c��Na+����Ҫ����NaCl��HClŨ����Դ�С�ж�c��Na+����c��H+����С��
D�����ζ���ˮ����V��HCl��=10 mLʱ����Һ�е�����Ϊ�����ʵ������Ȼ�狀�һˮ�ϰ�����Һ�д��ڵ���غ�������غ㣬���ݵ���غ�������غ��жϣ�
��� �⣺δ��HClʱ����ͬŨ�ȵİ�ˮ��NaOH��Һ��pH��NaOH���ڰ�ˮ������ͼ֪��IΪ�ζ�NaOH���ߣ�IIΪ�ζ���ˮ���ߣ�
A����V��HCl��=20 mLʱ��HCl�Ͱ�ˮǡ����ȫ��Ӧ�����Ȼ�泥��Ȼ����ǿ������������Һ�����ԣ���c��H+����c��OH-�������ݵ���غ�֪��c��Cl-����c��NH4+����笠�����ˮ��̶Ƚ�С����������Ũ�ȴ�С˳����c��Cl-����c��NH4+����c��H+����c��OH-������A��ȷ��
B��pH=7ʱ����Һ��c��H+��=c��OH-�������ݵ���غ��c��NH4+��=c��Cl-�����Ȼ����Һ�����ԣ�Ҫʹ�����Һ�����ԣ���ˮӦ��������������V��HCl����20mL����B��ȷ��
C���ζ�����������Һʱ����V��HCl����20 mL����Һ��c��H+����c��OH-������ϵ���غ��c��Cl-����c��Na+����Ҫ����NaCl��HClŨ����Դ�С�ж�c��Na+����c��H+����С������Ũ�ȴ�С˳�������c��Cl-����c��Na+����c��H+����c��OH-����Ҳ������c��Cl-����c��H+����c��Na+����c��OH-������C����
D�����ζ���ˮ����V��HCl��=10 mLʱ����Һ�е�����Ϊ�����ʵ������Ȼ�狀�һˮ�ϰ�����Һ�д��ڵ���غ�������غ㣬���ݵ���غ��c��NH4+��+c��H+��=c��Cl-��+c��OH-�������������غ��2c��Cl-��=c��NH4+��+c��NH3•H2O�������Ե�2[c��OH-��-c��H+��]=c��NH4+��-c��NH3•H2O������D��ȷ��
��ѡC��
���� ���⿼���������Һ�����жϼ�������ʵĵ��룬Ϊ��Ƶ���㣬���ؿ���ѧ�������жϼ�������������ȷ��Һ�����ʼ������ʡ����ʵ����ʵ����ǽⱾ��ؼ���ע�����غ�������غ�������Ũ�ȴ�С�Ƚ��е�������ã��״�ѡ����C��


 ���ٴ�����ɽ����ϵ�д�
���ٴ�����ɽ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ʯ�;���� | B�� | CO2��SiO2 | C�� | KCl��HBr | D�� | NaOH��NaCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
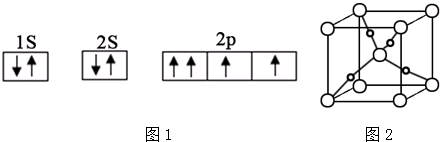
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
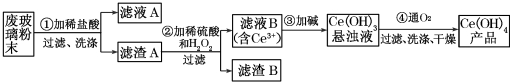
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
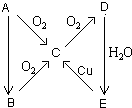 A��B��C��D��E����������һ�������µ�ת����ϵ��ͼ��ʾ��
A��B��C��D��E����������һ�������µ�ת����ϵ��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{c��C{H}_{3}COOH��}{c��O{H}^{-}��}$ | B�� | $\frac{c��O{H}^{-}��}{c��{H}^{+}��}$ | C�� | c��H+����c��OH-���ij˻� | D�� | OH-�����ʵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
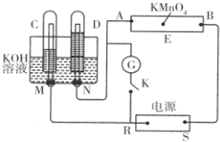 ����һ�绯ѧװ�ã���ͼ��ʾ��E Ϊմ�� Na2SO4��Һ����ֽ�������뼸�η�̪��A��B�ֱ�ΪPtƬ��ѹ����ֽ���ˣ�R��SΪ��Դ�ĵ缫��M��N���ö��� Ni �Ƴɵĵ缫���ϣ����ڼ�����Һ�п�����Ϊ���Ե缫��GΪ�����ƣ�KΪ���أ�C��D�͵����ж�����ŨKOH��Һ��������ֽ�������һ����ɫ�� KMnO4��Һ���Ͽ�K����ͨ���Դһ��ʱ���C��D�������������
����һ�绯ѧװ�ã���ͼ��ʾ��E Ϊմ�� Na2SO4��Һ����ֽ�������뼸�η�̪��A��B�ֱ�ΪPtƬ��ѹ����ֽ���ˣ�R��SΪ��Դ�ĵ缫��M��N���ö��� Ni �Ƴɵĵ缫���ϣ����ڼ�����Һ�п�����Ϊ���Ե缫��GΪ�����ƣ�KΪ���أ�C��D�͵����ж�����ŨKOH��Һ��������ֽ�������һ����ɫ�� KMnO4��Һ���Ͽ�K����ͨ���Դһ��ʱ���C��D��������������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com