
能正确表示下列反应离子方程式的是
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+=SO42-+3S↓+H2O
C.氢氧化镁与稀盐酸反应:H++OH-=H2O
D.Ba(OH)2溶液与稀硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
科目:高中化学 来源:2014-2015学年山西省晋中市高三1月考前适应性训练理综化学试卷(解析版) 题型:选择题
下列叙述错误的是
A.在加热搅拌条件下加入MgO,可除去MgCl2溶液中的Fe3+
B.pH=4.5的番茄汁中c(H+ )是pH=6.5的牛奶中c(H+)的100倍
C.常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):C(Na+)=c(CH3COO―)>c(CH3COOH)>c(H+)=c(OH―)
D.常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd@+)是c(Co)的3.5倍。已知:KSP(Cd(OH)2)=7.2×10-15, KSP(Co(OH)2)=1.8×10-15
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一上学期第二次月考化学试卷(解析版) 题型:填空题
(19分)某化学课外兴趣小组为探究铜与浓硫酸的反应,用下图所示的装置进行实验:


请回答下列问题:
(1)B是用收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整。
(2)实验中他们取6.4g铜片和12mL18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
①写出铜与浓硫酸反应的化学方程式:_________________________________________;
实验中若有m g铜参加了反应,则有______mol硫酸被还原,电子转移数目为___。
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是__________(填写字母编号)。
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是
__________________________________________________________________。
(3)为了测定消耗硫酸的物质的量,该兴趣小组设计了两个实验方案:
方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫。
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量。
实际上,方案一、二均不可取。
方案一产生的气体中含有 ,使干燥管增重偏大;也可能由于
,使干燥管增重偏小。
方案二:由于 与氯化钡溶液反应,使测定消耗硫酸的物质的量结果偏大。
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一上学期第二次月考化学试卷(解析版) 题型:选择题
下列物质的俗称、主要成分的化学式及其用途均正确的是
A.磁铁矿——Fe2O3——炼铁 B.胆矾——CuSO4·5H2O——波尔多液
C.蓝宝石——SiO2——饰品 D.纯碱——NaHCO3——焙制糕点
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省广安市高三“一诊”理综化学试卷(解析版) 题型:填空题
(14分)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2 H2(g)+CO(g) CH3OH(g);
CH3OH(g);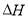 =-a KJ·mol-1(a>0)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0)。初始投料与各容器达到平衡时的有关数据如下:
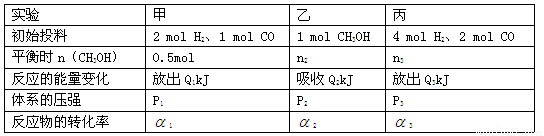
(1)该温度下此反应反应物的总键能和 (填“大于”“等于”或“小于”)生成物的总键能和。
(2)在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则H2的平均反应速率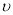 ( H2)为 。
( H2)为 。
(3)下列选项能说明甲容器中的反应已经达到平衡状态的有 (填序号)。
A.容器内H2、CO、CH3OH的物质的量之比为2:1:1
B.容器内气体的密度保持恒定
C.容器内H2气体的体积分数保持恒定
D.2V正(H2)=V逆(CO)
(4)丙容器中,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是
(填字母序号)。
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡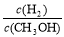 减小
减小
E.平衡常数K增大
(5)三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.Q1+Q2=a B.α3<α1
C.P3<2P1=2P2 D.n2<n3<1.0mol
(6)已知:①3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H=—247kJ·mol-l
CH3OCH3(g) +CO2(g) △H=—247kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H= -24 kJ·mol-l
CH3OCH3(g)+H2O(g) △H= -24 kJ·mol-l
③CO(g)+H2O(g) CO2(g)+H2(g) △H= -41 kJ·mol-l
CO2(g)+H2(g) △H= -41 kJ·mol-l
2 H2(g)+CO(g) CH3OH(g);
CH3OH(g);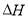 =-a KJ·mol-1 ,则 a=
=-a KJ·mol-1 ,则 a=
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都郫县高三第二次阶诊断性考试理综化学试卷(解析版) 题型:填空题
(18分)A、B、C、D、E都是周期表中前四周期的元素。已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。B的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数相同,B位于元素周期表的S区。C元素原子的外围电子层排布式为nsn—1npn—1。D原子M能层为全充满状态,且最外层无成对电子,E的化合物种类最多。请回答下列问题:
(1)写出D基态原子的电子排布式 ;
(2)A的常见氢化物AH3 的VSEPR模型为
(3)已知A和C形成的化合物X中每个原子的最外层均为8电子稳定结构,则X的化学式为 ,X是一种超硬物质,耐磨损、抗腐蚀能力强,
推测X的晶体类型为 。
(4)E的最高价氧化物的结构式为 中心原子的杂化方式为 。
(5)B的单质与A的最高价含氧酸的稀溶液反应,能将A还原至最低价态,写出该反应的化学方程式 。
(6)TiO2的天然晶体中,最稳定的一种晶体结构如下图,黑球表示 原子。
(7)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基离子结合形成的小分子化合物,该化合物中Fe2+与环戊二烯基离子之间以 (填“离子键”、“金属键”、“配位键”、“氢键”、“范德华力”)相结合。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都郫县高三第二次阶诊断性考试理综化学试卷(解析版) 题型:选择题
下列有关物质分类或归纳不正确的是
①电解质:明矾、冰醋酸、氯化银、纯碱 ②化合物:BaCl2、Ca(OH)2、HNO3、HT
③混合物:盐酸、漂白粉、水玻璃、水银 ④同素异形体:金刚石、石墨、C60、C70
A.①② B.②③ C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:实验题
(14分)某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。请填写下列空白:
Ⅰ.测定过氧化氢的含量
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250 mL_______(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为________。
(3)判断滴定到达终点的现象是_________________________。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为____________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
实验内容 | 实验方法 | 实验现象 |
验证氧化性 | ||
验证不稳定性 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港等四市高三一模化学试卷(解析版) 题型:实验题
《化学实验》邻苯二甲酸二异癸酯为无色粘稠液体,密度约为0.966g·cm-3,不溶于水,易溶于有机溶剂,常用作耐热塑料增塑剂。某实验小组的同学用下图所示装置制取少量邻苯二甲酸二异癸酯(图中夹持和加热装置已略去),主要操作步骤如下:
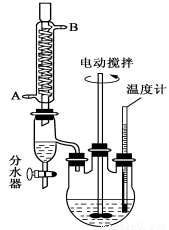
①向三颈烧瓶内加入0.05g钛酸四异丙酯、95.7g异癸醇及37.3g邻苯二甲酸酐;
②搅拌,升温至210℃,持续搅拌反应3小时;
③冷却至室温,将反应混合物倒出,抽滤;
④滤液用饱和碳酸氢钠洗涤、分液,再用蒸馏水洗涤、分液,得到粗产品;
⑤将粗产品加入蒸馏装置,减压蒸馏,获得成品。
请回答下列问题:
(1)加入钛酸四异丙酯的作用为 。
(2)步骤②中升温至210℃,持续搅拌反应3小时的目的是 ;
判断反应已结束的方法是 。
(3)步骤③抽滤时用到的硅酸盐质仪器有 、 。
(4)步骤④中分液时,得到粗产品的实验操作为 。
(5)步骤⑤中减压蒸馏的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com