
【题目】一定温度下,某体积不变的密闭容器进行的可逆反应:3A(s) ![]() 2B(g)+C(g),下列各关系中能说明反应已达到平衡状态的是( )
2B(g)+C(g),下列各关系中能说明反应已达到平衡状态的是( )
A.生成 B和C的速率比为2:1B.生成2n molB同时生成n molC
C.混合气体的密度不变D.混合气体的平均相对分子量不变
【答案】C
【解析】
达到平衡状态时正、逆反应速率相等,正、逆反应速率相等是指用同一种物质来表示的反应速率,不同物质表示的反应速率与化学计量数成正比。
A.生成B的速率和生成C的速率均为正反应速率,生成B和C的速率比为2:1,是化学方程式的化学计量数之比,不能表示正、逆反应速率相等,不能说明反应已达到平衡状态,故A不选;
B.生成2nmolB同时生成nmolC,均表示正反应速率,生成B和C的物质的量之比为2:1,是化学方程式的化学计量数之比,不能表示正、逆反应速率相等,不能说明反应已达到平衡状态,故B不选;
C.反应物A为固体,生成物B、C为气体,随着反应的进行,气体质量发生改变,容器体积不变,则密度也会发生改变,当混合气体密度不变时,说明B、C的质量不再发生改变,则正、逆反应速率相等,反应达到了平衡状态,故C选;
D.反应物A为固体,生成物B和C均为气体,且物质的量比恒定为2:1,混合气体的平均分子量为定值,则混合气体的平均分子量不变不能说明反应已达到平衡状态,故D不选;
答案为C。


科目:高中化学 来源: 题型:
【题目】(1)原电池中发生的化学反应属于________,原电池将________能转化成________能。
(2)如图为铜锌原电池:此电池中锌做________(填:正或负)极,发生________(填:氧化或还原)反应;铜极的电极方程式为________,电子流动的方向是:________(填:铜→锌或锌→铜)。
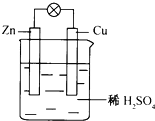
(3)工业上冶炼金属钠的方程式为:________,冶炼方法是:________;氧化铁和铝粉发生铝热反应的化学方程式为:________。铝热反应的用途:________(写出一种);工业上常用乙烯和水在一定条件下制取乙醇,其化学方程式为:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:

下列叙述错误的是
A. X、Y和Z均能使溴水褪色
B. X和Z均能与NaHCO3溶液反应放出CO2
C. Y既能发生取代反应,也能发生加成反应
D. Y可作加聚反应单体,X可作缩聚反应单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。

(1)Fe还原水体中NO3-的反应原理如图1所示。
①作负极的物质化学式为___________。
②正极的电极反应式是_________________________________________。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_____________________________________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图2所示,可得到的结论是____________________。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为_________,解释加入Fe2+提高NO3-去除率的原因:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为原料制得的山梨酸醇(A)和异山梨酸醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物。由葡萄糖为原料合成E的路线如下:

回答下列问题:
(1)葡萄糖的分子式为______;A中含有的官能团的名称为_______。
(2)C的结构简式为_______;由B到C的反应类型为____。
(3)由D到E的反应方程式为:_________。
(4)F是B的同分异构体。7.30g的F与足量饱和碳酸氢钠反应可释放出2.24LCO2(标准状况),F的可能结构有_____种(不考虑立体异构);其中核磁共振氢谱为三组峰,峰面积比为3:1:1的结构为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废水中可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、CO32-、S2-、SO32-、SO42-。现取该溶液进行有关实验,实验过程及现象如图所示:
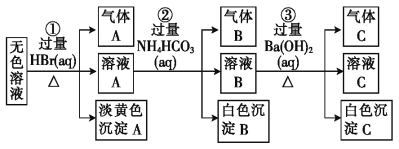
下列说法不正确的是
A.根据实验①中的现象可推出,淡黄色沉淀一定不是AgBr
B.根据实验②中的现象可推出,气体B是CO2,沉淀B是Al(OH)3,原溶液中一定含有AlO2-
C.根据实验③中的现象可推出,气体C是NH3,沉淀C一定有BaCO3,可能有BaSO4
D.原溶液中肯定含有Na+、AlO2-、S2-,不能确定是否含有SO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是一种强还原性的碱性液体,是一种用途广泛的化工原料,实验室用如图装置制备(部分装置省略)。

步骤1关闭K2、K3,打开K1,制备NaClO。
步骤2关闭K1、K2,打开K3,通入N2一段时间;关闭K3,打开K2,通入NH3,制备N2H4·H2O。
回答下列问题:
(1)盛放碱石灰的仪器的名称为___________。
(2)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有__________(填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(3)步骤2中通入N2一段时间的原因是____________________。
(4)本装置中制备氨气的化学方程式是______________________________。
(5)NH3与NaClO反应生成N2H4·H2O的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L密闭容器中通入amol气体A和bmol气体B,在一定条件下发生反应:xA(g)+yB(g) ![]() pC(g)+qD(g)已知:平均反应速率v(C)=
pC(g)+qD(g)已知:平均反应速率v(C)=![]() v(A);反应2min时,A的浓度减少了
v(A);反应2min时,A的浓度减少了![]() ,B的物质的量减少了
,B的物质的量减少了![]() mol,有
mol,有![]() molD生成。回答下列问题:
molD生成。回答下列问题:
(1)反应2min内,v(A)=______________;v(B)=______________;
(2)下列叙述能说明该反应已达平衡状态的是:______;
A、 xV(A)正=qV(D)逆 B、气体总的质量保持不变 C、C的总质量保持不变 D、混合气体总的物质的量不再变化 E、混合气体总的密度不再变化 F、混合气体平均分子量不再变化
(3)反应平衡时,D为2amol,则B的转化率为________;
(4)其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较,反应速率_____(是“增大”“减小”或“不变”),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答有关问题:
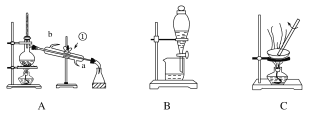
(1)装置A中玻璃仪器①的名称是________,进水的方向是从____口(填字母)进水。
(2)利用装置B分液时为使液体顺利滴下,应进行的具体操作是_________________。
(3)从氯化钾溶液中得到氯化钾固体,应选择装置________(填字母,下同);从碘水中分离出I2,应选择装置________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com