
| A. | 四种物质中一定有共价化合物 | B. | 四种物质中一定有Ba(OH)2 | ||
| C. | 丙溶液加热蒸干可得原无水溶质 | D. | 丁溶液中含有HCO3- |
分析 由②0.1mol•L-1乙溶液中c(H+)>0.1mol•L-1可知乙溶液为多元酸,再根据所给八种离子可知乙溶液为:H2SO4;
由①甲溶液分别与其它三种溶液混合,均产生白色沉淀,再结合乙溶液为硫酸,可知甲溶液中含有Ba2+,再结合溶液中其他离子可知甲溶液为Ba(OH)2;
由③向丙溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,可知丙溶液中有Cl-,丙溶液中的阳离子不能确定;
溶液中还剩下一种阴离子HCO3-,所以丁溶液中含有HCO3-.
解答 解:A.由②0.1mol•L-1乙溶液中c(H+)>0.1mol•L-1可知乙溶液为多元酸,再根据所给八种离子可知乙溶液为:H2SO4,故A正确;
B.由①甲溶液分别与其它三种溶液混合,均产生白色沉淀,再结合乙溶液为硫酸,可知甲溶液中含有Ba2+,再结合溶液中其他离子可知甲溶液为Ba(OH)2,故B正确;
C.由③向丙溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,可知丙溶液中有Cl-,而丙溶液中的阳离子不能确定,可能是Mg2+,也可能是NH4+,二者的溶液蒸干都不能得到原物质,故C错误;
D.溶液中还剩下一种阴离子HCO3-,所以丁溶液中含有HCO3-,故D正确;
故选C.
点评 本题考查了溶液中离子组成的判断,要结合离子之间的反应,根据现象如:沉淀、气体等进行判断.


科目:高中化学 来源: 题型:解答题
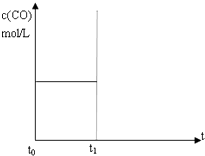 水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO(g)+H2 (g)△H=+131.3kJ•mol-1
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO(g)+H2 (g)△H=+131.3kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题
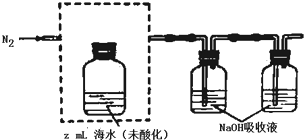
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2不溶于水,也不溶于酸和碱 | B. | SiO2是制造太阳能电池的常用材料 | ||
| C. | 硅是地壳中含量最多的非金属元素 | D. | 水玻璃可用作木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂离子电池放电时电池反应为LiMO2+C6Li1-x═C6Li+Li1-xMO2 | |
| B. | 锂离子电池充电时电池内部Li+向负极移动 | |
| C. | 锂离子电池放电时电池内部电流从负极流向正极 | |
| D. | 锂离子电池充电时阳极反应为C6Li1-x+xLi++xe-═C6Li |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
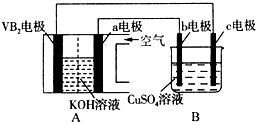 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )| A. | 电解过程中,c电极表面先有红色物质析出,然后有气泡产生 | |
| B. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| C. | 外电路中电子由c电极流向VB2电极 | |
| D. | 若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
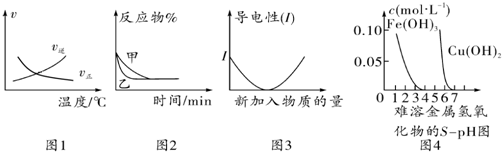
| A. | 根据图1可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H<0 | |
| B. | 图2可能表示压强对可逆反应 A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 图3可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. | 根据图4,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量Cu至pH在4左右 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用容量瓶、量筒、滴定管等仪器时,先用水洗后还需待装液润洗 | |
| B. | 洗涤沉淀的操作是将沉淀置于滤纸上(已放置在漏斗中),边用玻璃棒搅拌边加蒸馏水冲洗 | |
| C. | 为提升燃料电池的效率,通常可以用KNO3代替蒸馏水,同时作电极的碳棒先灼烧,然后投入到冷水中,反复3-5次 | |
| D. | 在制取乙酸乙酯的实验中,收集乙酸乙酯的试管中加的是饱和Na2CO3溶液,而且导管直接插入到饱和Na2CO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com