
【题目】常温下,将10mL pH=1的CH3COOH溶液加水稀释至100mL后,溶液中的pH值为( )
A.2
B.2<pH<7
C.1<pH<2
D.无法判读
【答案】C
【解析】解:CH3COOH为弱酸,加水稀释时醋酸还要电离生成氢离子,pH=1的CH3COOH溶液中氢离子浓度为0.1mol/L,稀释至100mL后,醋酸的电离程度增大,则溶液中氢离子浓度大于:0.1mol/L× ![]() =0.01mol/L,所以稀释后的溶液的pH小于:﹣lg0.01=2;加水稀释氢离子浓度减小,则pH变大,所以稀释后的溶液的pH>1,
=0.01mol/L,所以稀释后的溶液的pH小于:﹣lg0.01=2;加水稀释氢离子浓度减小,则pH变大,所以稀释后的溶液的pH>1,
综上可知,稀释后的醋酸溶液:1<pH<2;
故选C.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】尿黑酸症是一种引起酪氨酸在人体内非正常代谢的遗传病,酪氨酸在体内有如图转化: 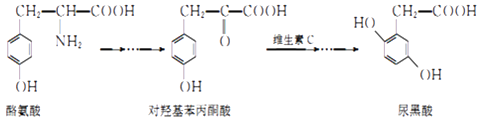
下列说法错误的是( )
A.酪氨酸既能与盐酸反应,又能与NaOH溶液反应
B.1mol尿黑酸与足量浓溴水反应,最多消耗3molBr2
C.对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个
D.对羟基苯丙酮酸分子核磁共振氢谱有4个峰,有1个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得1mol H2与1mol Cl2反应生成2mol HCl时,放出184.6kJ的热量,其理论分析数据与实验数据略有差异,如图表示上述反应能量变化的理论分析示意图:
(1)化学键断裂需要(填“释放”或“吸收”)能量;
(2)图中表示了吸收和释放的能量,其中释放的能量共kJ;
(3)该反应的反应物的总能量(填“大于”、“等于”或“小于”)反应产物的能量,所以该反应是(填“放热”或“吸热”)反应;
(4)用图示数据计算其反应热,写出该反应的热化学方程式 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用电化学法还原CO2是一种使CO2资源化的方法,如图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( ) 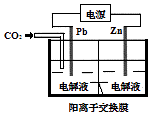
A.Pb与电源的正极相连
B.ZnC2O4在离子交换膜右侧生成
C.正极反应式为:Zn﹣2e﹣═Zn2+
D.标准状况下,当11.2 L CO2参与反应时,转移0.5mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL的某稀H2S04溶液中滴入0.1mol/L氨水,溶液中水电离出氢离子浓度随滴人氨水体积变化如图.下列分析正确的是( ) 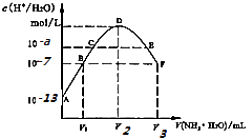
A.稀硫酸的浓度为0.1mol/L
B.C点溶液pH=14﹣a
C.E溶液中存在:c(NH4+)>c(SO42﹣)>c(H+)>c(OH﹣)
D.B到D、D到F所加氨水体积一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,某化合物X受热分解:2X=A↑+2B↑+4C↑。测得反应后生成的混合气体对H2的相对密度为d,在相同条件下,X的相对分子质量是
A. 2d B. 7d C. 5d D. 3.5d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
A.CO(g)+ ![]() O2(g)═CO2(g);△H=﹣283.0 kJ/mol
O2(g)═CO2(g);△H=﹣283.0 kJ/mol
B.C(s)+ ![]() O2(g)═CO(g);△H=﹣110.5 kJ/mol
O2(g)═CO(g);△H=﹣110.5 kJ/mol
C.H2(g)+ ![]() O2(g)═H2O(g);△H=﹣241.8 kJ/mol
O2(g)═H2O(g);△H=﹣241.8 kJ/mol
D.2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l);△H=﹣11036 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=;若其他条件不变,容器体积缩小为1L,则K值 . (增大、减小或不变);若K300°C>K350°C , 则该反应是热反应.
(2)用O2表示从0~2s内该反应的平均速率v=;
(3)能说明该反应已达到平衡状态的是
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离除NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol;
Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() O2(g)△H=﹣226kJ/mol
O2(g)△H=﹣226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283 kJ
B.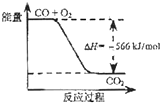
如图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>﹣452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com