
【题目】用惰性电极电解足量的下列溶液,一段时间后停止电解,向溶液中加入一定质量的另一种物质(括号内),能使溶液完全复原的是( )
A.CuCl2( H2O) B. NaOH(Na2O) C.CuSO4( CuO) D. NaCl( NaOH)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下图oa表示在密闭容器中反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0达到平衡过程,由于条件改变引起反应速度和化学平衡发生a~d的一系列变化,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ;若增大压强时,将反应速度变化情况画在c~d处。(注意:画在图中,无图不给分)
2NH3(g)△H<0达到平衡过程,由于条件改变引起反应速度和化学平衡发生a~d的一系列变化,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ;若增大压强时,将反应速度变化情况画在c~d处。(注意:画在图中,无图不给分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求对下图中两极进行必要的连接并填空:
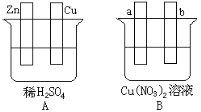
(1)在A图中,使铜片上冒H2气泡。请仅用导线进行必要的连接,此时铜板发生___________反应。电极反应式,锌板: 。
(2)在B图中,a、b均为石墨电极,若使a极析出铜,则请用导线等进行必要的连接,则b析出: 。电极反应式,a极: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是

A.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol
3H2+CO,每消耗1molCH4转移12mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废铅蓄电池量急速增加所引起的铅污染日益严重。工业上从废铅蓄电池的铅膏中回收铅的工艺流程如下:
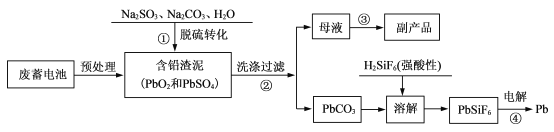
(1)铅蓄电池的总反应为Pb+ PbO2+2H2SO4 =2PbSO4+2H2O,该蓄电池放电时的负极反应式为__________,放电后该电极质量_______(填“增大”“减小”或“不变”)。
(2)步骤①中加入Na2SO3的作用是____________。
(3)写出步骤②证明PbCO3沉淀已经洗涤干净的实验操作方法:_______________。
(4)若用NH4HCO3和NH3·H2O为脱硫转化剂,也可对上述流程中的含铅渣泥进行处理。如图是NH4 HCO3和NH3.H2O用量对含铅渣泥中脱硫率的影响:

从图形可以看出,应选择NH4HCO3和NH3·H2O用量为理论用量的__________倍。该条件下步骤③从母液可获得副产品为_______________ 。
(5)步骤④使用纯铅和粗铅作电极,PbSiF6作电解质,可进行粗铅精炼。则阳极的电极材料是_________,阴极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把单质铁加入氯化铜、氯化亚铁、氯化铁和盐酸混合溶液中,反应后铁有剩余,则溶液中浓度最大的阳离子是( )
A. Cu2+ B. Fe2+ C. Fe3+ D. H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究锌与盐酸反应过程中速率变化,他在100ml稀盐酸中加足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表所示(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/ml | 50 | 120 | 232 | 290 | 310 |
①哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大?____________
②哪一时间段的反应速率最小____________,原因是_______________________。
③求2~3 min时间段以盐酸的浓度变化来表示的该反应速率是____________。
④如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水、B.NaCl溶液、C.NaNO3溶液、D.ZnSO4溶液、E.Na2CO3溶液,
你认为可行的是________(填字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com