
| A、饱和Na2CO3溶液 |
| B、澄清石灰水 |
| C、CaCl2溶液 |
| D、盐酸 |


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案科目:高中化学 来源: 题型:
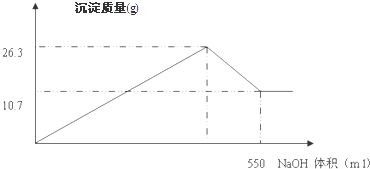
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHS水解反应:HS-+H2O═H3O++S2- | ||||
B、少量铁与热的浓硝酸反应:Fe+6HNO3(浓)
| ||||
C、 如图装置中石墨电极上的电极反应为:O2+4e-+2H2O=4OH- | ||||
D、湿法炼铜的原理:Cu2S+O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl-、Ba2+、Mg2+、ClO- |
| B、Cl-、SO42-、Cu2+、Mg2+ |
| C、Cl-、SO42-、K+、Na+ |
| D、HCO3-、NO3-、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在水中溶解性:Na2CO3<NaHCO3 |
| B、热稳定性:Na2CO3>NaHCO3 |
| C、同浓度溶液与足量酸反应的速度:Na2CO3>NaHCO3 |
| D、将固体溶于少量水放出的热量:Na2CO3<NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制造钢轨的材料是钢,钢是用量最大的合金 |
| B、钢的熔点比铁的熔点高,而铁的用途更广泛 |
| C、我国在商代就开始使用铜合金 |
| D、铝合金的强度、硬度比组成合金各成分金属的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com