
 ����������ѧ��Ϊ��ѡ���룩bc��
����������ѧ��Ϊ��ѡ���룩bc������ A��B��C��D�����ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ�ص�ԭ��ֻ��һ�����Ӳ㣬A��Cͬ���壬��AΪHԪ�أ�B��Dͬ���壬�ֱ��ڶ��������ڣ�����������֮������Ϊ11����Ԫ�ص�ԭ�Ӻ���������֮����A��C��Ԫ��ԭ�Ӻ���������֮�͵Ķ�����C������ΪLi������֪CΪNa����B��D������֮��Ϊ��1+11����2=24����B��������Ϊx����D��������Ϊx+8����x+x+8=22�����x=8����BΪOԪ�ء�DΪSԪ�أ���������Ԫ�صĵ��ʳ��³�ѹ�����������塢���ֹ��壬�ݴ˽��
��� �⣺A��B��C��D�����ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ�ص�ԭ��ֻ��һ�����Ӳ㣬A��Cͬ���壬��AΪHԪ�أ�B��Dͬ���壬�ֱ��ڶ��������ڣ�����������֮������Ϊ11����Ԫ�ص�ԭ�Ӻ���������֮����A��C��Ԫ��ԭ�Ӻ���������֮�͵Ķ�����C������ΪLi������֪CΪNa����B��D������֮��Ϊ��1+11����2=24����B��������Ϊx����D��������Ϊx+8����x+x+8=22�����x=8����BΪOԪ�ء�DΪSԪ�أ���������Ԫ�صĵ��ʳ��³�ѹ�����������塢���ֹ��壮
��1��DΪSԪ�أ��������ڱ��е������ڢ�A�壬��H��O����Ԫ�ؿ��γ�E��F���ֻ��������һ�ֻ�����ֽ�������һ�ֻ����Ӧ��H2O2�ֽ�����H2O��O2���÷�Ӧ����ʽΪ��2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2����H2O2�ĵ���ʽ�� ��������Hԭ����Oԭ��֮���γɼ��Լ�����ԭ��֮���γɷǼ��Լ���
��������Hԭ����Oԭ��֮���γɼ��Լ�����ԭ��֮���γɷǼ��Լ���
�ʴ�Ϊ���������ڢ�A�壻2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2���� ��bc��
��bc��
��2������Ԫ����ɵĻ�������SԪ��Ϊ���ۣ�˵��OԪ�ضԼ��ϵ���������ǿ��OԪ�طǽ�����ǿ���ʢ���ȷ��
�ڵ��ʵ��۷е������������ʣ����ܱȽϽ�����ǿ�����ʢڴ���
����̬�⻯���ȶ�������Ԫ�صķǽ�����Խǿ���ʢ���ȷ��
�ʴ�Ϊ���٢ۣ�
��3����H��O��S����Ԫ���е����ֿɷֱ��γɼס����������ӣ����Ǿ�Ϊ��һ��˫ԭ�Ӻ˵������ӣ��Ҽ���18�����ӣ��Һ���10�����ӣ����ΪHS-����ΪOH-��������ҷ�Ӧ�����ӷ���ʽΪ��HS-+OH-=S2-+H2O��
�ʴ�Ϊ��HS-+OH-=S2-+H2O��
��4������������ϡ���ᷴӦ������������ˮ����֪�˷�Ӧ����1molH2Oʱ�ų�������Ϊ57.3kJ����÷�Ӧ�Ȼ�ѧ����ʽΪ��2NaOH��aq��+H2SO4��aq��=Na2SO4��aq��+2H2O��l����H=-114.6kJ/mol��
�ʴ�Ϊ��2NaOH��aq��+H2SO4��aq��=Na2SO4��aq��+2H2O��l����H=-114.6kJ/mol��
��5���������������Ƴɵ�أ������װ��KOHŨ��Һ���ö�Ľ������Ե缫����KOH��Һ����M��ͨ�������ĵ��ʣ�N��ͨ�������ĵ��ʣ���������������Ӧ����M���Ǹõ�صĸ�����N��������ԭ��Ӧ��������õ��ӣ������������������������缫��ӦʽΪ��O2+2H2O+4e-=4OH-��
�ʴ�Ϊ������O2+2H2O+4e-=4OH-��
���� ���⿼��ṹ����λ�ù�ϵӦ�ã��漰����ʽ���ǽ�����ǿ���Ƚϡ��Ȼ�ѧ����ʽ��ԭ��صȣ��ƶ�Ԫ���ǽ���ؼ���AΪ����Ԫ������һ�����Ӳ�Ϊ�ƶ�ͻ�ƿڣ�ע������ԡ��ǽ�����ǿ���Ƚ�ʵ����ʵ���Ѷ��еȣ�


 ��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 +Br2
+Br2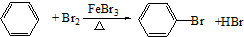
 +HO-NO2
+HO-NO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ����I | ����II |
| A | ��֬�����Ͷ����� | һ�������¶��ܷ���������Ӧ |
| B | CuSO4����������Ӿ�������� | ͭ����ʹ�����ʱ��� |
| C | ���ǡ����ۡ���ά���ǻ�ԭ���� | ����һ�������¶��ܷ���������Ӧ |
| D | �����ʽṹ�д����ļ� | �������ܱ��ֳ����� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����������ѧ��Ϊ��ѡ���룩bc��
����������ѧ��Ϊ��ѡ���룩bc���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʯ���ѽ�õ��������Ǵ����� | |
| B�� | ʯ�ͷ����ú�����������仯 | |
| C�� | ú������Եõ����顢���Ͱ�����Ҫ����ԭ�� | |
| D�� | ˮú����ͨ��ú��Һ���õ�������ȼ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1mol•L-1��ij��Ԫ�������ʽ��NaHA��Һ�У�c��Na+��=2c��A2-��+c��HA-��+c��H2A�� | |
| B�� | 25��ʱ��pH=12�İ�ˮ��pH=12������������ϣ�c��Cl-����c��NH${\;}_{4}^{+}$����c��H+����c��OH-�� | |
| C�� | ������������ʵ���Ũ�ȵĴ��������������Һ��ϣ�c��OH-��=c��H+��+c��CH3COOH�� | |
| D�� | ��NH4HSO4��Һ�м�������ʵ�����NaOH�γɵ���Һ�У�c��Na+��=c��SO${\;}_{4}^{2-}$��+c��NH${\;}_{4}^{+}$��+c��H+��+c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ʵ������������������ֱ���ȫȼ�գ����߷ų������� | |
| B�� | ��ϡ��Һ�У�H+��aq��+OH-��aq���TH2O��l������H=-57.3 kJ/mol��������0.5 mol H2SO4��Ũ�����뺬1 mol NaOH����Һ��ϣ��ų�����������57.3 kJ | |
| C�� | ��C��ʯī��=C�����ʯ����H=+1.90 kJ/mol��֪ʯī�Ƚ��ʯ�ȶ� | |
| D�� | ��101 kPaʱ��2 g H2 ��ȫȼ������Һ̬ˮ���ų�285.8 kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2��g��+O2��g���T2H2O��g����H=-571.6kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=6���������� | B�� | [H+]=10-6mo1•L-1����ҺΪ���� | ||
| C�� | [OH-]=10-6mo1•L-1����ҺΪ���� | D�� | �¶Ȳ���ϡ��10����pH=7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ӻ�ˮ����ȡ�����ͨ����ѧ��Ӧ����ʵ�� | |
| B�� | �ú����Ƽ�ƴ������ͨ����ѧ��Ӧ����ʵ�� | |
| C�� | �á��ع��͡���������������ȼ�͡��Ĺ��̷������ǻ�ѧ�仯 | |
| D�� | ʯī�ڸ��¸�ѹ��ת��Ϊ���ʯ�ǻ�ѧ�仯 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com