
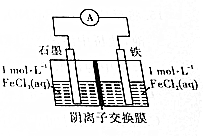
| A. | FeCl3和FeCl2可以互换位置,对反应无影响 | |
| B. | 该电池总反应为FeCl3+Fe═2FeCl2 | |
| C. | 若溶解2.8g铁,约有0.1molCl-从交换膜左向右迁移 | |
| D. | 一段时间后,阴膜左、右侧离子数变化量之比约为2:3 |
分析 A、金属铁可以和氯化铁之间发生反应,但是金属铁和氯化亚铁之间不会发生反应,根据能量的转化率来回答;
B、该电池总反应为负极金属和电解质之间的自发氧化还原反应;
C、根据电极反应式结合电子守恒来计算回答;
D、根据两极上放电的微粒以及离子的移动方向来回答.
解答 解:A、金属铁可以和氯化铁之间发生反应,但是金属铁和氯化亚铁之间不会发生反应,FeCl3和FeCl2不能互换位置,否则能量的转化率极低,电极本身和电解质之间会发生反应,故A错误;
B、该电池总反应为负极金属和电解质之间的自发氧化还原反应,即2FeCl3+Fe═3FeCl2,故B错误;
C、若溶解2.8g即0.05mol铁,根据负极反应Fe-2e-=Fe2+,转移电子是0.1mol,有0.1molCl-从交换膜移向负极,即氯离子左向右迁移,故C正确;
D、左侧电极上是铁离子得电子的反应2Fe3++2e-=2Fe2+,同时电解质里的阳离子移向该电极,右侧电极上是金属铁失电子的氧化反应Fe-2e-=Fe2+,转移电子的量、两极上得失电子的量是相等的,假设电子转移是2mol,则左侧2mol氯离子通过阴离子交换膜移向右侧,右侧有1mol亚铁离子生成,同时得到2mol氯离子,故左右侧离子的变化数为2:3,故D正确
故选CD.
点评 本题考查学生原电池和电解池的工作原理以及应用方面的知识,属于综合知识的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | FeO42- 只做氧化剂 | |
| B. | O2是还原产物 | |
| C. | □处对应的物质是H2O | |
| D. | 若10 mol H+参加反应,转移的电子的物质的量是10 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤②④ | B. | ②④③①⑤ | C. | ③①②⑤④ | D. | ②④①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL 1mol•L-1Fe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA | |
| B. | 室温下,pH=13的NaOH溶液中含OH-数目为NA | |
| C. | 室温下,1L pH=12的Ba(OH)2溶液中OH-数目为0.2NA | |
| D. | 室温下,1L pH=1的盐酸中,由水电离的H+数目为10-13NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
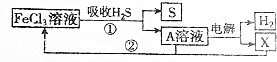
| A. | A溶液中溶质的成分为FeCl2 | B. | X为Cl2并且在阴极上生成的 | ||
| C. | 废气中的H2S最终转化为S和H2 | D. | 只有流程①为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | z>y>x | B. | x=y>2z | C. | x=y<$\frac{z}{2}$ | D. | x=y>$\frac{z}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 9.820g晶体中含有C2O42-的物质的量为0.006mol | |
| B. | 配制草酸合铁酸钾溶液玻璃仪器只需烧杯和玻璃棒 | |
| C. | 该晶体的化学式为K3Fe(C2O4)3•6H2O | |
| D. | 9.820g样品中含K+的物质的量为0.06 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com