
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示: ① 3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
② Na2FeO2+ NaNO2+ H2O → Na2Fe2O4+ NH3↑+ NaOH
③ Na2FeO2+Na2Fe2O4+2H2O Fe3O4+4NaOH
Fe3O4+4NaOH
(1)配平化学方程式②。
(2)上述反应①中还原剂为 ,若有1mol Na2FeO2生成,则反应中有 mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是 。
A.该生产过程不会产生污染 B.反应③生成的四氧化三铁具有抗腐蚀作用
C.反应①②③均是氧化还原反应 D.反应①②中的氧化剂均为NaNO2
(4)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是: 。
【知识点】氧化还原反应的应用。
【答案解析】 (1)6,1,5,3,1,7 (2)Fe 2 (3) BD (4) 反应③可逆,氢氧化钠浓度过大,平衡向逆反应方向移动。
解析:(1)化学反应②中,Fe元素的化合价升高了一价,但氮元素的化合价降低了6价,所以Na2FeO2的系数是6,NaNO2的系数是1,根据原子守恒既得。
(2)Fe元素化合价升高,失去电子,是还原剂;;根据反应②,转移电子是6mol,则有1molNa2FeO2生成,则反应中有2mol电子转移。
(3)A.该生产过程生成的氨气是有毒气体,会污染空气,故A错误;
B.四氧化三铁具有抗腐蚀作用,故B正确;
C.反应①②均是有元素化合价变化的反应,是氧化还原反应,故C错误;
D.反应①②中化合价降低的N元素所在的反应物NaNO2是氧化剂,故D正确.
(4)反应Na2FeO2+Na2Fe2O4+2H2O Fe3O4+4NaOH可逆,当氢氧化钠浓度过大,平衡向逆反应方向移动,此时四氧化三铁的量会减小,“发蓝”的厚度会变小,
Fe3O4+4NaOH可逆,当氢氧化钠浓度过大,平衡向逆反应方向移动,此时四氧化三铁的量会减小,“发蓝”的厚度会变小,
【思路点拨】本题是一道关于氧化还原反应知识的综合考查题,注意知识的梳理和归纳是解题的关键,难度不大.


科目:高中化学 来源: 题型:
下列过程中发生取代反应的是
A.乙烯通往Br2的CCl4溶液中生成1,2 ---二溴乙烷
B.乙醇在空气中燃烧生成CO2和H2O
C.用氯乙烯制聚氯乙烯
D.甲烷与氯气混合后光照生成一氯甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)
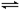 2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:
2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:
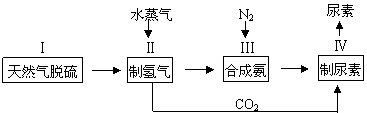 |
(1)步骤II中制氢气原理如下:
CH4(g)+H2O(g)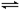 CO(g)+3H2(g) CO(g)+H2O(g)
CO(g)+3H2(g) CO(g)+H2O(g)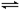 CO2(g)+H2(g)
CO2(g)+H2(g)
恒容容器中,对于以上反应,能加快反应速率的是 。
a. 升高温度 b. 充入He c. 加入催化剂 d. 降低压强
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为 。
(3)CO2和H2在高温、高压、催化剂条件下可合成CH3CH2OH,反应的化学方程式
_________________________________。以CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:_________________________。
(4)已知尿素的结构简式为H2N-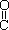 -NH2,请写出尿素的同分异构体中含有离子键的化学式 。
-NH2,请写出尿素的同分异构体中含有离子键的化学式 。
 (5)已知CO2+ 2NH3 CO(NH2)2 + H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成 吨尿素。
(5)已知CO2+ 2NH3 CO(NH2)2 + H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成 吨尿素。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是
A. Ba(OH)2溶液与稀硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B. Fe与FeCl3溶液反应:Fe+Fe3+=2Fe2+
C.大理石中加入稀盐酸:CaCO3+2H+=Ca2++CO2↑+H2O
D. AlCl3溶液中加过量氨水:Al3++3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氯的说法正确的是
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.若1735Cl、1737Cl为不同的核素,有不同的化学性质
C.实验室制备Cl2,可用排饱和食盐水法收集
D.1.12 LCl2含有1.7NA个质子(NA 表示阿伏伽德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
次磷酸钠(NaH2PO2)可用于化学镀镍。
(1)化学镀镍的溶液中含有Ni2+ 和H2PO2-,在酸性条件下发生以下镀镍反应:
① Ni2+ + H2PO2-+ → Ni + H2PO3-+
② 6H2PO2- +2H+ →2P+4H2PO3-+3H2↑
请配平反应式①。
(2)反应式①中还原剂是 ,被还原元素是 。
(3)反应②中,若生成1 mol H2PO3-,反应中转移电子的物质的量为 mol。
(4)从二个反应分析,若生成1mol Ni和1mol P,同时有 mol H2PO3-生成。
(5)完成下列各小题中的化学反应方程式:
碱金属与O2反应生成氧化物较复杂,有普通氧化物(如K2O)过氧化物(如K2O2)还有超氧化物和臭氧化物等。要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。写出下列化学反应方程式:
①钠与过氧化钠反应
②钾还原硝酸钾,同时还产生了一种单质气体
查看答案和解析>>
科目:高中化学 来源: 题型:
孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:
x CuCO3 • y Cu(OH)2(x、y为正整数且x≤2,y≤2)。
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石耗用的盐酸的物质的量与生成的CO2的物质的量之比为4︰1;石青则为3︰1。请推算它们的化学组成(化学式)。
孔雀石: ;石青: 。
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2 4.48 L(标准状况下);加热另一份样品使其完全分解,得到CuO 28 g,试通过计算确定该混合物中孔雀石和石青的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列性质比较中不正确的是 ( )
A.沸点的高低: B.熔点:SiO2>CsCl>CBr4>CF4
B.熔点:SiO2>CsCl>CBr4>CF4
C.硬度:镁>铝>镁铝合金 D. 水溶性:HF>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应mA(g)+nB(g)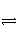
 pC(g)+qD(g),开始时容器内充入A和B或C和D,下图中的甲和乙分别表示反应达平衡后,改变压强和温度对反应速率和化学平衡的影响,则下列关系中正确的是( )
pC(g)+qD(g),开始时容器内充入A和B或C和D,下图中的甲和乙分别表示反应达平衡后,改变压强和温度对反应速率和化学平衡的影响,则下列关系中正确的是( )
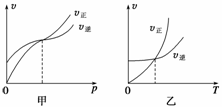
A.开始时充入A和B,m+n>p+q,反应放热
B.开始时充入A和B,m+n<p+q,反应吸热
C.开始时充入C和D,m+n>p+q,反应放热
D.开始时充入C和D,m+n>p+q,反应吸热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com