
| A. | 0.1mol的OH-中含有的电子数为0.9NA | |
| B. | 标准状况下,11.2 L CCl4所含分子数为0.5NA | |
| C. | 6.02×1022个 CH4所含氢原子数为0.4NA | |
| D. | 常温常压下,28 g N2中所含原子个数为NA |
分析 A.氢氧根离子中含有10个电子,0.1mol氢氧根离子含有1mol电子;
B.标准状况下四氯化碳不是气态;
C.根据阿伏伽德罗常数NA=6.02×1023计算;
D.根据n=$\frac{m}{M}$计算出氮气的物质的量,然后可计算出含有N原子数.
解答 解:A.0.1mol的OH-中含有1mol电子,含有的电子数为NA,故A错误;
B.标准状况下,四氯化碳不是气体,不能使用标准状况下的气体摩尔体积计算,故B错误;
C.6.02×1022个 CH4所含氢原子数为:6.02×1022×4=0.4NA,故C正确;
D.28g氮气的物质的量为:$\frac{28g}{28g/mol}$=1mol,1mol氮气分子中含有2molN原子,所含原子个数为2NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标准状况下气体摩尔体积的使用条件,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:实验题
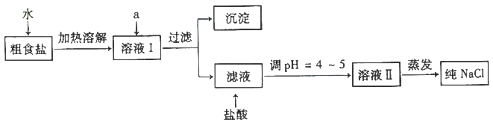
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L的氨水 | B. | 0.01mol/L的NaOH | ||
| C. | 0.01mol/L的CH3COOH | D. | 0.01mol/L的HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池充电时,阴极反应式为:PbSO4+2e-=Pb+SO42- | |
| B. | 用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌 | |
| C. | 钢柱在水下部分比在空气与水交界处更容易腐蚀 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
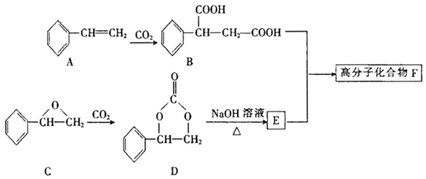
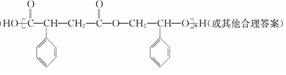
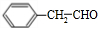 ,G与新制的Cu(OH)2悬浊液混合加热时发生反应的化学方程式为
,G与新制的Cu(OH)2悬浊液混合加热时发生反应的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| B. | IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| C. | 氯最高价氧化物对应的水化物为HClO4;则氟最高价氧化物对应的水化物HFO4 | |
| D. | NaHSO4与NaHSO3溶于水显酸性,由所有酸式盐溶于水显酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com