
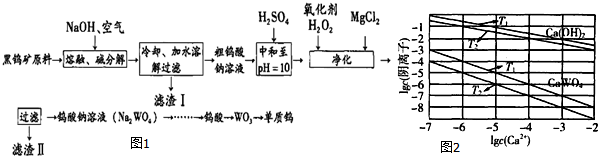
分析 由流程可知,钨酸亚铁和氢氧化钠、氧气反应生成氧化铁和钨酸钠,钨酸锰和氢氧化钠反应生成钨酸钠和氢氧化锰,水浸时,氧化铁和氢氧化锰不溶于水,钨酸钠溶于水,故过滤后得到的滤液含钨酸钠,滤渣I的主要成份是Fe2O3、MnO2,钨酸钠和浓硫酸反应生成钨酸和硫酸钠;加入过氧化氢,氧化+5价的钨为+6价,加入氯化镁,生成难溶于水的MgSiO3、MgHAsO4、MgHPO4,过滤,滤液为钨酸钠,酸化,加热分解产生三氧化钨和水,用还原剂还原三氧化钨生成钨.
(1)根据在化合物中正负化合价代数和为零,确定钨酸盐(FeWO4、MnWO4)中钨元素的化合价;根据流程图的提示锰的钨酸盐和氢氧化钠和氧气反应生成MnO2等物质;
(2)根据以上分析,加入H2O2的目的是将HAsO32-氧化成HAsO42-,据此书写离子反应方程式;
(3)T1时KSP(CaWO4)=c(Ca2+)•c(WO42-),根据表中该温度下离子的浓度代入计算即可;将钨酸钠溶液加入石灰乳得到钨酸钙沉淀和氢氧根离子,据此书写离子反应式,反应平衡常数K等于生成物平衡浓度系数次方之积和反应物平衡浓度系数次方之积,据此计算T2时该反应的平衡常数;
(4)电解时阴极得到电子,由于电解质溶液是酸性介质,所以阴极是氢离子放电生成氢气,碳化钨做阳极,碳化钨(WC)失去电子生成H2WO4.
解答 解:(1)钨酸盐FeWO4为钨酸亚铁,钨酸盐(FeWO4、MnWO4)中铁、锰的化合价都为+2价,设钨酸盐(FeWO4、MnWO4)中钨元素的化合价为+x,因化合物中正负化合价代数和为零,则+2+x+(-2)×4=0,解得x=+6,黑钨矿的主要成分是铁和锰的钨酸盐,根据流程图的提示知,黑钨矿在空气中熔融生成WO42-、MnO2,、Fe2O3等,其中转化中生成MnO2的化学反应方程式为2MnWO4+O2+4NaOH=2MnO2+2Na2WO4+2H2O,
故答案为:+6;2MnWO4+O2+4NaOH$\frac{\underline{\;高温\;}}{\;}$2MnO2+2Na2WO4+2H2O;
(2)根据以上分析,加入H2O2的目的是将HAsO32-氧化成HAsO42-,离子方程式为H2O2+HAsO32-═HAsO42-+H2O,滤液I中存在SiO32-、HAsO32-、HAsO42-、HPO42-等离子,经过调解pH值后,加入氯化镁,Mg2+沉淀SiO32-、HAsO32-、HAsO42-、HPO42-等离子,滤渣Ⅱ的主要成分是MgSiO3、MgHAsO4、MgHPO4,
故答案为:H2O2+HAsO32-═HAsO42-+H2O;MgSiO3、MgHAsO4、MgHPO4;
(3)T1时KSP(CaWO4)=c(Ca2+)•c(WO42-)=1×10-5×1×10-5=1×10-10,将钨酸钠溶液加入石灰乳,发生复分解反应,氢氧化钙和钨酸根离子反应生成钨酸钙沉淀,反应的离子方程式为:WO42-+Ca(OH)2=CaWO4+2OH-,T2时,C(OH-)=10-2mol/L,c(WO42-)=10-7mol/L,平衡常数K等于生成物平衡浓度系数次方之积和反应物平衡浓度系数次方之积,即K=$\frac{{c}^{2}(O{H}^{-})}{c(W{{O}_{4}}^{2-})}$=$\frac{(1{0}^{-2})^{2}}{1{0}^{-7}}$=1×103,
故答案为:1×10-10;WO42-+Ca(OH)2=CaWO4+2OH-;1×103;
(4)电解时,阴极是氢离子放电生成氢气,电极反应式是2H++2e-=H2↑,阳极是碳化钨失去电子,发生氧化反应:WC+6H2O-10e-=H2WO4+CO2↑+10H+,
故答案为:WC+6H2O-10e-=H2WO4+CO2↑+10H+.
点评 本题以钨矿原料制备W的工艺流程为载体,考查了氧化还原反应原理、对工艺流程的理解、常用化学用语等,题目难度中等,理解工艺流程是解题的关键,需要学生具有扎实的基础与综合运用知识分析、解决问题的能力.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题
| R | ||
| X | Y | Z |
| A. | 原子半径大小顺序是:Y>X>R | |
| B. | 其气态氢化物的稳定性顺序是:Z>Y>X>R | |
| C. | X、Y、Z中Z的氧化物对应的水化物的酸性最强 | |
| D. | R的气态氢化物与它的含氧酸之间能发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 220mL | B. | 240mL | C. | 260mL | D. | 280mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 溴苯(溴) | 水 | 分液 |
| B | 乙醇(乙酸) | NaOH溶液 | 分液 |
| C | 甲烷(乙烯) | KMnO4酸性溶液 | 洗气 |
| D | 苯(苯酚) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
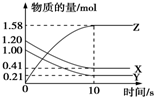 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应开始到10 s,用Z表示的反应速率为0.158 mol•L-1•s-1 | |
| B. | 反应开始到10 s时,平均反应速率:v(X)=v(Y)=0.039 5 mol•L-1•s-1 | |
| C. | 10 s后,该反应停止进行 | |
| D. | 反应的化学方程式为2X(g)+Y(g)?2Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠离子与氯离子F之间存在互相吸引又互相排斥的相互作用 | |
| B. | 不存在氯化钠的分子 | |
| C. | 每个钠离子同时吸引6个氯离子,每个氯离子同时吸引6个钠离子 | |
| D. | 在一个钠离子周围距离相等,并且最接近的钠离子共有6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
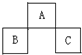 A、B、C均为周期表中的短周期的元素,它们在周期表的位置如下图.已知B、C两元素在周期表中族数之和是A元素族数的2倍;B、C元素的原子序数之和是A 元素的原子序数的4倍,则A、B、C所在的一组是 ( )
A、B、C均为周期表中的短周期的元素,它们在周期表的位置如下图.已知B、C两元素在周期表中族数之和是A元素族数的2倍;B、C元素的原子序数之和是A 元素的原子序数的4倍,则A、B、C所在的一组是 ( )| A. | Be、Na、Al | B. | P、O、Cl | C. | O、P、Cl | D. | C、Al、P |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com