
| A. | 铜制品在潮湿空气中生锈,其主要原因是发生了析氢腐蚀 | |
| B. | 铜的电解精炼工业中,沉积在电解槽底部的阳极泥可作为提炼金、银等贵重金属的原料 | |
| C. | 泡沫灭火器中所装试剂为Na2CO3和Al2(SO4)3 | |
| D. | 从海水中可以制取NaCl,电解饱和NaCl溶液可以制金属Na |
分析 A.铜排在氢的后面,不能与酸反应生成氢气;
B.铜的电解精炼工业中,阳极上金属失电子变成离子进入溶液,比金属铜活泼性差的金、银等固体会沉积下来形成阳极泥;
C.泡沫灭火器中所装试剂为NaHCO3和Al2(SO4)3;
D.电解饱和NaCl溶液的实质是:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
解答 解:A.铜不能置换出氢气,所以铜制品在潮湿空气中生锈,其主要原因是发生吸氧腐蚀,故A错误;
B.铜的电解精炼工业中,阳极上金属失电子变成离子进入溶液,比金属铜活泼性差的金、银等固体会沉积下来形成阳极泥,可作为提炼金、银等贵重金属的原料,故B正确;
C.泡沫灭火器中所装试剂为NaHCO3和Al2(SO4)3,不是Na2CO3和Al2(SO4)3,故C错误;
D.电解饱和NaCl溶液电解过程中阳极上氯离子失电子发生氧化反应,2Cl--2e-=Cl2↑;阴极上是氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑,实质是:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑得不到金属钠,故D错误;
故选B.
点评 本题考查了电解精炼铜原理、铜的腐蚀、泡沫灭火剂、电解等知识,题目难度不大,掌握基础是关键.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | NA个氢气分子所占的体积为22.4L | B. | 2NA个二氧化碳分子的质量为44g | ||
| C. | 32g O2所含的氧原子数目是2NA | D. | 17g氨气中所含原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列反应合成甲醇CO(g)+2H2(g)?CH3OH(g)△H
甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列反应合成甲醇CO(g)+2H2(g)?CH3OH(g)△H| 温度 | 250℃ | 300℃ | 350℃ |
| K | 3.041 | 1.000 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用丁达尔效应可以区分淀粉溶胶和肥皂水 | |
| B. | 1L1 mol•L-1Fe(OH)3胶体中,胶粒数目小于NA | |
| C. | PM2.5是指大气中直径接近于2.5×10-6m(1m=109nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 | |
| D. | Fe(OH)3胶体的电泳实验说明了胶体带有电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有反应的反应热都可以由实验直接测定 | |
| B. | 任何化学反应都需要用活化能来引发 | |
| C. | 200°C、101KPa时,1g氢气与碘蒸气作用生成HI气体,放出7.45kJ热量,则此过程的热化学方程式可表示为:H2(g)+I2(g)=2HI(g)△H=-14.9kJ/mol | |
| D. | 没有物质的变化,就不能引发能量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3 | B. | MgSO4 | C. | Na2SO3 | D. | Ca(HCO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


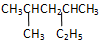 的系统命名是:2,4-二甲基己烷
的系统命名是:2,4-二甲基己烷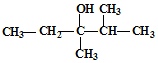 的键线式是
的键线式是
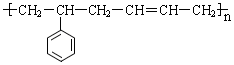 的单体结构简式为:
的单体结构简式为: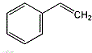 和CH2=CH-CH=CH2
和CH2=CH-CH=CH2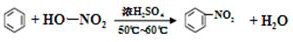

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com