
| ʵ �� �� Ʒ | �� Һ �� �� | �к��� ��H | |||
| t1 | t2 | ||||
| �� | 50mL0.55mol��L-1NaOH | 50mL.0.5mol��L-1HCl | 20�� | 23.3�� | |
| �� | 50mL0.55mol��L-1NaOH | 50mL.0.5mol��L-1HCl | 20�� | 23.5�� | |

| 3.3��+3.5�� |
| 2 |
| 1mol |
| 0.025mol |
| 0.03mol |
| 0.02L |


 �п������п��Ծ����ϵ�д�
�п������п��Ծ����ϵ�д� ��������״Ԫ��ϵ�д�
��������״Ԫ��ϵ�д� �ƸԿ�����ҵ��ϵ�д�
�ƸԿ�����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ͭ��ϡ���ᷴӦ��Cu+2H++NO3-�TCu2++NO��+H2O |
| B������������Һ�м����������ữ�Ĺ���������Һ��Fe2++2H++H2O2�TFe3++2H2O |
| C�������Ķ�����̼ͨ��Ư����Һ�У�ClO-+CO2+H2O�THClO+HCO3- |
| D��AlCl3��Һ�м��������ˮ��Al3++4NH3?H2O�TAlO2-+2H2O+4NH4+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ط�¡�����ķ���ϩ���ĵ����Ƿ�������CCl2F2�� |
| B�����������ɰ������γɵIJ��ɽ���ĸ߷��ӻ������ˮ��Һ�ж�������� |
| C��������ԱӦѸ��Զ��Һ��й©�ص㣬��˳�緽����ɢ |
| D��AgI�ɱ����������˹����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
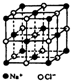 ����ѧ--����3�����ʽṹ�����ʡ�
����ѧ--����3�����ʽṹ�����ʡ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ | B������ |
| C���������� | D������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com