
| ||

| 消耗量 |
| 起始量 |
| ||
| mg |
| 80g/mol |
| mg |
| 233g/mol |
| ||||
|
| ||||
|


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
| A、在标准状况下,将22.4L氨气溶于1L水中,得到1mol?L-1的氨水 |
| B、配制0.1mol?L-1的Na2CO3溶液480mL,需用500mL容量瓶 |
| C、10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49% |
| D、向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2、和Na2O,使溶液均恰好饱和则加入的Na2O2与Na2O的物质的量之比等于1:1(温度不变) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取干燥洁净的酸式滴定管立即装入标准盐酸 |
| B、用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定 |
| C、往盛有20.00mL NaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定 |
| D、用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
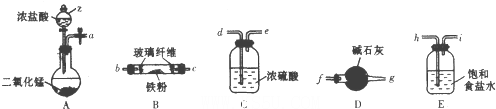
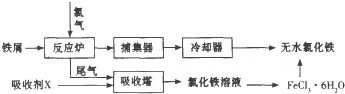
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,下列说法正确的是( )
,下列说法正确的是( )| A、苹果酸中能发生酯化反应的官能团有2种 |
| B、1 mol苹果酸可与3 mol NaOH发生中和反应 |
| C、1 mol苹果酸与足量金属Na反应生成1 mol H2 |
D、 与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Al3+、HCO3-、NO3- |
| B、AlO2-、Cl-、Mg2+、K+ |
| C、NH4+、Na+、CH3COO-、NO3- |
| D、Na+、NO3-、ClO-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
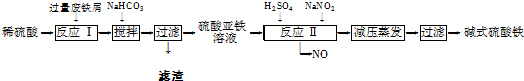
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com