
| A. | 4种 | B. | 6种 | C. | 7种 | D. | 8种 |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取LKSCN溶液,向试管中滴入1~2滴0.1mol/LKSCN溶液 | (1)若出现红色,则假设1成立; (2)若未出现红色,则假设2或假设3成立. |
步骤2:另取2~3mL样品溶液于试管中滴入1~2mL品红稀溶液 | 1若品红溶液红色褪色,假设2成立; 2若品红溶液不褪色,结合步骤1中的(2)则假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
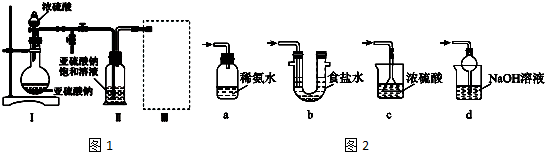

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 生成等量的CuSO4时,②消耗的酸最少,且能体现绿色化学思想 | |
| B. | 反应⑥中Y可以是葡萄糖或乙醛溶液 | |
| C. | 反应④所得混合气体X中一定有O2 | |
| D. | 反应①中H2SO4与HNO3物质的量最佳比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2++CO32-=CaCO3↓(写离子方程式).Ca2++CO32-=CaCO3↓ |
| 操作2:向2mL NaHCO3溶液中滴加少量的澄清石灰水 | 白色沉淀 | 反应的离子方程式为Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4敞口久置会增重 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 胆矾放入装有浓H2SO4的干燥器中,过一段时间胆矾变白色 | |
| D. | 在稀HNO3中放入铝片就产生NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com