

���� ��1����ѧƽ�ⳣ����ָ��һ���¶��£����淴Ӧ����ƽ��ʱ���������Ũ��ϵ������֮���뷴Ӧ���Ũ��ϵ������֮���ıȣ����塢��Һ�岻��Ҫ�ڻ�ѧƽ�ⳣ����д��������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���
��2������ѹǿ��ƽ���������С�ķ����ƶ���ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죻
��3���ں�ѹ�����£���������ͨ�뺤����He����������μӷ�Ӧ������Ũ�ȼ�С��ƽ�������ƶ���
��4��a������ѹǿ��Ӧ���ʼӿ죬ƽ�����ƣ�
b��ʹ�ô�������Ӱ��ƽ���ƶ�����������Խ��Ӧ����Խ�죻
c�������¶ȷ�Ӧ���ʼӿ죬ƽ�������ƶ���
��5������������ԭ��Ӧ��������������õ��ӣ������ʴ�����H+������ɰ�����
��� �⣺��1��N2��g��+3H2��g��?2NH3��g����ƽ�ⳣ������ʽK=$\frac{{c}^{2}��N{H}_{3}��}{c��{N}_{2}����{c}^{3}��{H}_{2}��}$������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ������
�ʴ�Ϊ��$\frac{{c}^{2}��N{H}_{3}��}{c��{N}_{2}����{c}^{3}��{H}_{2}��}$������
��2������ѹǿ��ƽ���������С�ķ����ƶ�����������Ӧ�����ƶ���ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬�ı�ѹǿ��ƽ�ⳣ�����䣬
�ʴ�Ϊ��������Ӧ�����䣻Kֻ���¶��йأ�
��3���ں�ѹ�����£���������ͨ�뺤����He����������μӷ�Ӧ������Ũ�ȼ�С��ƽ�������ƶ���������ת���ʼ�С���ʴ�Ϊ����С��
��4��a������ѹǿ��Ӧ���ʼӿ죬ƽ�����ƣ��������������Ӧ����a����
b��ʹ�ô�������Ӱ��ƽ���ƶ�����������Խ��Ӧ����Խ�죬ͼ����ȷ����b��ȷ��
c�������¶ȷ�Ӧ���ʼӿ죬ƽ�������ƶ������������������С����c����
�ʴ�Ϊ��b��
��5������������ԭ��Ӧ��������������õ��ӣ������ʴ�����H+������ɰ����������缫��ӦʽΪ��N2+6e-+6H+=2NH3��
�ʴ�Ϊ��N2+6e-+6H+=2NH3��
���� ���⿼���Ϊ�ۺϣ�Ϊ�߿��������ͣ��漰��ѧƽ��ļ�����Ӱ�����ء���ѧƽ��ͼ���ԭ���ȣ���Ŀ�Ѷ��еȣ���4����ע�������ȹ���ƽ��ֵ��ԭ���붨����һ������ͼ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ�Ӱ뾶��Z��M��N��X��Y | B�� | M��N�γɵĻ�������N������ | ||
| C�� | ���ʷе㣺Z��M��N��Y��X | D�� | ������ۣ�N��M=Y��Z=X |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | RCl | B�� | RCl2 | C�� | RCl3 | D�� | RCl4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
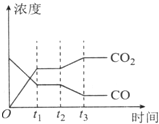 ���ܼ����ǵ��»����������ص㣮
���ܼ����ǵ��»����������ص㣮| H2O | CO | C02 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
| ������� | c��CO��/mol•L-1 | c��02��/mol•L-1 | c��C02��/mol•L-1 | V��������v���棩�Ƚ� |
| �� | 2.0��10-4 | 4.0��10-4 | 4.0��10-2 | V������=v���� |
| �� | 3.0��10-4 | 4.0��10-4 | 5.0��10-2 | V�������� v���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �ȼ��仯�������������������й㷺����;���ش��������⣺
�ȼ��仯�������������������й㷺����;���ش��������⣺| ������� | �¶�/�� | �������/L | Cl02��g����ƽ��ת���� |
| a | T1 | V1=l L | 75% |
| b | T1 | v2 | |
| c | T3 | v3 | 75% |
| d | |||
| e |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
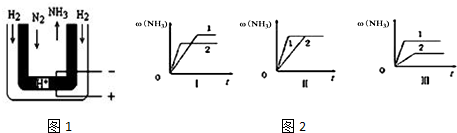
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ȼ��Ϊ������ | |
| B�� | ��Ȼ���Dz�����������Դ | |
| C�� | ��ϩ�Ľṹ��ʽΪCH2CH2 | |
| D�� | ������CH4��Cl2�ڹ��������·�Ӧֻ����CH3Cl��HCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ������ | K+��Al3+��Mg2+��Ba2+ Fe3+ |
| ������ | NO3-��CO32-��SiO32-��SO42- OH- |
| ��� | ʵ������ | ʵ���� |
| �� | �����Һ�м�������ϡ���� | ������ɫ�������ų���״����1.12L���� |
| �� | ����ķ�Ӧ���Һ���ˣ��Գ���ϴ�ӡ����������أ��������ù������� | ��������Ϊ4.8g |
| �� | ������Һ�еμ�BaCl2��Һ | ���������� |
| ������ | Ũ��c/��mol•L-1�� |
| ��CO32- | 0.5mol/L |
| ��SiO32- | 0.8mol/L |
| �� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com