
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
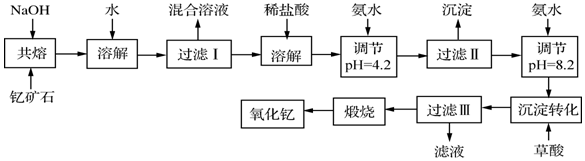
分析 钇矿石与氢氧化钠共熔,加水溶解后可生成Na2SiO3、Na2BeO2,以及Y(OH)3和Fe2O3沉淀,过滤后加入盐酸溶解,在此基础上加入氨水,由表中数据可知首先生成Fe(OH)3沉淀,加入草酸可生成Y2(C2O4)3,煅烧可生成Y2O3,
(1)依据元素化合价和原子守恒书写元素的氧化物组成;
(2)根据沉淀转化步骤可知过滤Ⅲ所得滤液的溶质;
(3)①周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似,欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀,所以Na2BeO2的性质和NaAlO2类比推断;加过量的盐酸,硅酸钠反应生成硅酸沉淀,Na2BeO2的反应生成氯化铍溶液,再加入过量氨水沉淀铍离子;
②Na2BeO2与足量盐酸反应生成氯化铍和氯化钠溶液;
(4)依据图表中的PH数据分析判断三价铁离子完全沉淀,钇离子不沉淀的溶液PH为3.7-6.0;继续加氨水调节pH=8.2是把钇离子全部沉淀的反应;
(5)根据Y2(C2O4)3比Y(OH)3更难溶可写出沉淀转化的化学方程式.
解答 解:(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为:Y2O3•FeO•2BeO•2SiO2,故答案为:Y2O3•FeO•2BeO•2SiO2;
(2)在过滤Ⅱ的滤液(含有YCl3)里加氨水后又加草酸,故过滤Ⅲ所得滤液的溶质为NH4Cl、(NH4)2C2O4,故答案为:NH4Cl、(NH4)2C2O4;
(3)①周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似,欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀,所以Na2BeO2的性质和NaAlO2类比推断;加过量的盐酸,硅酸钠反应生成硅酸沉淀,Na2BeO2的反应生成氯化铍溶液,再加入过量氨水沉淀铍离子,故答案为:bd;
②Na2BeO2与足量盐酸发生反应生成氯化铍氯化钠和水,反应的离子方程式为:BeO22-+4H+=Be2++2H2O,故答案为:BeO22-+4H+=Be2++2H2O;
(4)三价铁离子开始沉淀到沉淀完全的PH范围为:2.7-3.7;钇离子开始沉淀和沉淀完全的PH为:6.0-8.2;所以使Fe3+沉淀完全,须用氨水调节pH为3.7至6.0;继续加氨水调节pH=8.2是把钇离子全部沉淀的反应,故答案为:不能,第一步用氨水是为了使Fe3+ 转化为沉淀而除去;
(5)加草酸将Y(OH)3转化为Y2(C2O4)3的化学方程式:2Y(OH)3+3H2C2O4═Y2(C2O4)3+6H2O,故答案为:2Y(OH)3+3H2C2O4═Y2(C2O4)3+6H2O.
点评 本题考查了工艺流程图,为高频考点,侧重于学生的分析能力和实验能力的考查,注重试剂的选择,化学方程式的配平等,难度较大.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(g)△H1 2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2 | |
| D. | 2HCl(g)═H2(g)+Cl2(g)△H1 H2(g)+Cl2(g)═2HCl(g)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
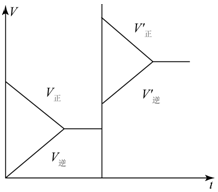 对于达平衡的可逆反应X+Y?W+Z,增大压强则正、逆反应速度(v)的变化如图,分析可知X、Y、Z,W的聚集状态可能是( )
对于达平衡的可逆反应X+Y?W+Z,增大压强则正、逆反应速度(v)的变化如图,分析可知X、Y、Z,W的聚集状态可能是( )| A. | Z、W为气体,X、Y中之一为气体 | B. | X、Y中之一为气体,Z、W为非气体 | ||
| C. | X、Y、Z、W皆为气体 | D. | X、Y为气体,Z、W中之一为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
| 实验方案 | 实验现象 | 实验结论 |
| 取5ml待测液加入维生素C,振荡,再加入1mlM溶液,加入至蒸馏水10mL,再振荡,与③好色阶对比 | 紫红色比③色阶浅 | 维生素C可以有效降低NaNO2的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{84{w}_{2}-53{w}_{1}}{31{w}_{1}}$ | B. | $\frac{84{w}_{2}-53{w}_{1}}{31{w}_{1}}$ | ||
| C. | $\frac{84{w}_{2}-53{w}_{1}}{31{w}_{1}}$ | D. | $\frac{115{w}_{2}-84{w}_{1}}{31{w}_{1}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4g | B. | 4.8g | C. | 17.6g | D. | 20.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用干净的铂丝蘸取少量溶液在酒精灯外焰上灼烧,发现火焰呈黄色,则溶液中无K+ | |
| B. | 检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液 | |
| C. | 向某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- | |
| D. | 向某溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀,则X中含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钠溶液可用作环境的杀菌消毒 | |
| B. | 硅胶可用作商品包装袋的干燥剂 | |
| C. | 爆竹燃放后,硫燃烧生成SO3 | |
| D. | 施肥时,草木灰不能与胺态氮肥混合使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com