
【题目】浓度均为0.1 mol·L-1、体积为V0的HA酸溶液和MOH碱溶液,分别加蒸馏水稀释,溶液pH随滴入的蒸馏水体积的变化曲线如图所示,下列叙述正确的是( )

A. HA为强酸,MOH为强碱
B. a点HA的电离度小于10%
C. 两种溶液无限稀释时,其c(H+)近似相等
D. 两种溶液稀释至V1时,b、c两点所示溶液中c(A-)>c(M+)
【答案】C
【解析】
本题考查强弱电解质的稀释问题。解答时根据图像的pH知HA为弱酸,MOH为强碱;又知道稀释时促进弱电解质电离,其电离度也增大。无论强碱还是弱酸无限稀释其c(H+)近似相等的; MOH为强碱,完全电离,而HA为弱酸,部分电离,浓度均为0.1 mol·L-1的HA酸溶液和MOH碱溶液稀释相同倍数时,c(M+)>c(A-)。
A.若HA为强酸,则0.1 mol·L-1的该溶液pH=1,而图中其pH=2, HA为弱酸,故A项错误;B.对于HA溶液,在滴加蒸馏水前,溶液pH=2,即溶液中c(H+)=0.01 mol·L-1,故其电离度为10%,溶液越稀,促进电离,其电离度增大,故a点HA的电离度大于10%,故B项错误;酸碱溶液无限稀释时,溶液中的c(H+)≈c(OH-)≈1×10-7mol·L-1,故C项正确;D.由图像知MOH为强碱,完全电离,而HA为弱酸,部分电离,浓度均为0.1 mol·L-1的HA酸溶液和MOH碱溶液稀释相同倍数时,c(M+)>c(A-),故D项错误。


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】恒温条件下将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s内正反应的化学反应速率为___________;
(2)反应前A的物质的量浓度是___________;
(3)平衡时A的转化率为___________;
(4)能说明该反应达到平衡状态的是______________。
A.消耗3molA同时生成2molC B.反应体系中各物质的百分含量不变
C.混合气体平均相对分子质量不变 D.2V正(A)=3V逆(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产生活中所采取的措施不能用化学反应速率解释的是
A.有些食物的标签上注明须冷藏B.在糕点制作过程中添加防腐剂
C.在轮胎制品中加入适量的炭黑D.燃煤发电时常用煤粉代替煤块
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是 ( )
A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的小
B.AgCl的悬浊液中c(Cl-)=4×10-5.5mol/L
C.将0.001 mol·L-1AgNO3溶液滴入0.001 mol·L-1的KCl,无沉淀析出
D.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1mol/L、体积为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg(V/ V0)的变化关系如图所示。下列叙述正确的是( )

A. HX、HY都是弱酸,且HX的酸性比HY的弱
B. 相同温度下,电离常数K(HX):a>b
C. 常温下,由水电离出的c(H+)·c(OH-):a<b
D. lg(V/ V0)=3,若同时微热两种溶液,则[c(X-)/c(Y-)]减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,五种元素核内质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)A2W的电子式为________。
(2)B中质子数和中子数相等的核素符号为____,E元素在周期表中的位置为_______ 。
(3)W、D、E三种元素的简单离子半径由小到大的顺序为_______(填离子符号)。
(4)在一定条件下,D元素的单质能与A元素的单质化合生成DA,DA能与水反应放氢气,则其化学方程式为_______,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是______L(标准状况下)。
(5)若要比较D和E的金属性强弱,下列实验方法可行的是_______。
a.将D单质置于E的盐溶液中,若单质D不能置换出单质E,说明D的金属性弱
b.将少量D、E的单质分别投入到水中,若D反应而E不反应,说明D的金属性强
C.比较相同条件下D和E的最高价氧化物对应水化物的溶解性若前者比后者溶解度大,说明D的金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物(如图)是农药生产中的一种中间体,其结构简式如下。下列叙述正确的是
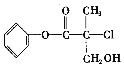
A. 该有机物属于芳香烃
B. 该有机物可以和Br2的CCl4溶液发生加成反应
C. 该有机物和浓硫酸混合加热,可能发生消去反应
D. 1mol该有机物和足量的NaOH溶液反应,最多可与3mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关胶体的说法正确的是
A. 有的胶体是纯净物,有的胶体是混合物
B. 有的胶体带电,有的胶体不带电
C. 工厂中常用的静电除尘装置是根据胶体的某些性质设计的
D. 胶体、溶液和浊液的本质区别是能否产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料的不断发展可以促进社会的进步,性能各异的各种材料的广泛应用大大提高了人们的生活水平。回答下列问题:
(1)橡胶是制造轮胎的重要原料,天然橡胶通过硫化处理,使它的分子转化为体型结构,从而增大橡胶的强度,橡胶属于____(填字母)。
a. 无机非金属材料 b. 金属材料 c. 有机高分子材料
保持洁净安全的生存环境已成为全人类的共识。
(2)为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量。为控制大气中二氧化硫的排放,常采取的措施是对化石燃料进行__________________ 。对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为 ___________________________________________ 。
(3)获得洁净安全的饮用水是每个人的正常需要。某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉或漂白精片进行杀菌消毒,其原理可用化学方程式表示为______________________________ 。
(4)天然水中含有细小悬浮颗粒或胶体颗粒,可以用 ____ (填一种物质的化学式)作为混凝剂净化处理。明矾净水工作原理的离子方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com